Содержание:
Криптоспоридиоз птиц — протозойное заболевание, вызываемое простейшими паразитами криптоспоридиями.
Криптоспоридии — это протозои, развивающиеся среди микроворсинок пищеварительного, респираторного и урогенитального трактов птиц. У криптоспоридий имеются половая и бесполая стадии размножения. В окружающую среду паразиты выделяются с помётом в форме спорулированных ооцист. Криптоспоридиоз является самым распространённым паразитозом птиц, вызываемым простейшими; поражает большое количество видов птиц и зарегистрирован на всех континентах, кроме Антарктиды.
Систематика
Таксономическое положение вида ранее определялось на основании морфологии и видоспецифичности. Сейчас систематика во многом определяется молекулярным анализом ДНК.
До недавнего времени криптоспоридии классифицировались как кокцидиоподобные паразиты, однако, после пересмотра особенностей строения и развития криптоспоридий, их систематическое положение сместилось выше.
Экстрацеллюлярные стадии развития паразита наблюдаются как в клеточных, так и в бесклеточных средах, в биопленках и in vivo. Это демонстрирует способность развиваться и размножаться без участия клеток хозяина. Кроме того, паразит не имеет микропиле, спороцисты, и полярной гранулы.
Поэтому, хотя первоначально криптоспоридии рассматривались как кокцидии, у них обнаружены признаки общие для кокцидий и грегарин, что подтверждается морфологическими и молекулярными исследованиями. Наибольшее сходство криптоспоридий и грегарин заключаются в:
— способность завершать жизненный цикл без клеток хозяина;
— наличие внеклеточных гамонтоподобных стадий развития (процесс, в котором два зрелых трофозоита спариваются перед образованием гаметоцисты (сизигия) );
— изменение клеточной архитектуры для адаптации к разнообразным условиям внешней среды (биопленка, целом, кишечник, почва, вода).
Видоспецифичность
У разных видов криптоспоридий разная видоспецифичность. Некоторые из них высокотропны к одному хозяину, другие же — поражают большое число разных видов животных. Некоторые виды паразитируют и у человека.
Паразитирование на человеке
У человека криптоспоридиоз вызывается в основном C. hominis, который специфичен только для человека (антропоноз). Также, у человека паразитоз вызывается C. parvum, C. meleagridis, C.cuniculus, C. ubiquitum — которые не являются видоспецифичными для человека паразитами и вызывают инфекцию у многих видов млекопитающих, птиц, рептилий, амфибий, рыб.
Виды криптоспоридий, поражающих млекопитающих, у птиц встречаются редко. При этом они могут вызывать развитие клинической инфекции (как например, C. parvum у авдоток (Burhinus oedicnemus) ), а также протекать без симптомов (как например, Cryptosporidium muris у африканских страусов).
Паразитирование у птиц
На сегодняшний день описано 4 вида криптоспоридий, вызывающих заболевания только у птиц:
Cryptosporidium baileyi (Current et al. 1986)
Cryptosporidium galli (Ryan et al. 2003b)
Cryptosporidium avium (бывший генотип V) (Holubová et al. 2016)
Cryptosporidium proventriculi (бывший генотип III) (Holubová et al. 2019
и 9 генотипов, которые специфичны для отдельных групп птиц, сюда входят:
avian genotypes I–IV
avian genotypes VI–IX (Helmy et al. 2017)
goose genotypes I–IV (Zhou et al. 2004)
goose genotypes Id (Cano et al. 2016)
duck genotypes I и II (Jellison et al. 2004; Morgan et al. 2001; Zhou et al. 2004)
duck genotype b (Cano et al. 2016)
Eurasian Woodcock genotype (Ryan et al. 2003a)
Finch genotypes I–III (Morgan et al. 2000)
genotype YS-2017 выделенный от сов (Makino et al. 2018)
Среди криптоспоридий птиц C. meleagridis поражает самый большой спектр видов пернатых. Впервые она была обнаружена у индеек. На сегодняшний день известно, что она вызывает заболевания у попугаев, цыплят, куропаток, голубей, а также опасна для собак, крупного рогатого скота, свиней, грызунов, человека.
C. meleagridis, C. galli и C. baileyi поражают большое количество видов птиц разных отрядов. C. avium и большинство генотипов криптоспоридий птиц очень видоспецифчны. С. proventriculi зарегистрирован у попугаеобразных, воробьиных, дятлообразных, гусиных, но чаще всего, судя по публикациям, встречается у попугаев.
C. parvum обычный возбудитель криптоспоридиоза у человека, редко встречается у домашней птицы. По мнению разных исследователей C. meleagridis встречающаяся у индюшек и являющаяся для них высокопатогенной, на самом деле может являться C. parvum.
Развитие
Криптоспоридии имеют моноксеновый цикл развития, т.е. все стадии развития проходят в организме одного хозяина.
Жизненный цикл
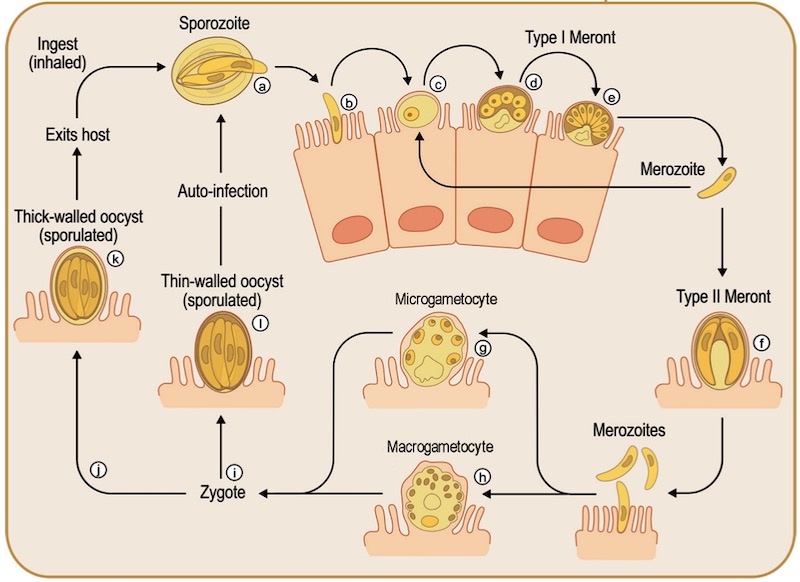
Схематическая диаграмма жизненного цикла криптоспоридий. Ооцисты открываются (процесс эксцистации) после заглатывания зараженной воды или еды. Этот этап запускается температурой, кислотой в желудке и желчными кислотами. Затем спорулированные ооцисты разрываются и из них выходят (а) спорозоиты, которые (b) внедряются в клетки хозяина, (с) индуцируя процесс обволакивания мембраной клетки хозяина, и образуется паразитоформная вакуоль (d), которая дифференцируется в трофозоит и проходит цикл бесполого размножения, (е) формируется меронт первого порядка, который содержит 6-8 мерозоитов. Эти мерозоиты могут реинфицировать эпителиальные клетки, где они подвергаются мерогонии и формируют меронты первого или (f) второго типов. (g) Мерозоиты могут дифференцироваться в половые клетки, называемые (g) микро- и (h) макрогаметоцитами. (i) После слияния образуется зигота (j) и клетка проходит цикл спорогонии, после чего образуется тонкостенная ооциста. (k) Эта тонкостенная ооциста выделяется вместе с помётом и инфицирует нового хозяина или (l) реинфицирует этого же хозяина. Адаптировано из Bouzid M, Hunter PR, Chalmers RM, Tyler KM. Cryptosporidium pathogenicity and virulence. Clin Microbiol Rev. 2013 Jan;26(1):115-34. doi: 10.1128/CMR.00076-12. PMID: 23297262; PMCID: PMC3553671.
В течение всего цикла развития разные стадии проходят на апикальной поверхности клеток хозяина. Механизм прикрепления инфицирующих спорозоитов к апикальной поверхности клеток хозяина плохо изучен, после прикрепления проходит процесс интернализации, в результате которого паразит оказывается внутки клетки хозяина в апикальной области, отделенной от основной цитоплазмы электронноплотным слоем, который, вероятно, продуцируется самой клеткой хозяина. Таким образом образуется паразитофорная вакуоль, со всех сторон окруженная плазмалеммой клетки хозяина, при этом паразит защищен от неблагоприятных услових внешней среды и получает питание от клетки хозяина через фидерную органеллу (feeder organelle). Фидерная органелла является уникальной для криптоспоридий, ни у каких других представителей споровиков такой структуры не обнаружено.
Криптоспоридии способны вызывать аутоинфекции того же хозяина. Аутоинфекцию поддерживают тонкостенные ооцисты, которые эксицистируются при отделении от эпителия, и цикл повторяется снова. Аутоинфекция и циклы бесполого размножения меронтов первого типа обеспечивают развитие инфекции и персистирующую хроническую инфекцию.
Cryptosporidium meleagridis
Эти криптоспоридии впервые были описаны в 1929 году Тиззером как возбудители криптоспоридиоза птиц, но через 35 лет их снова переоткрыли при изучении вспышки заболевания у индеек. Тогда же, в 1955 году, и было дано современное название. Морфологически ооцисты C. meleagridis не отличаются от C. parvum. Размеры ооцист 5.2 х 4.6 (4.5– 6.0 х 4.2–5.3)μм.
Cryptosporidium meleagridis обнаруживаются в тонком, толстом кишечнике и в бурсе, и вызвают инфекцию приводящую к развитию энтерита и повышенной смертности у разных видов птиц: индеек, попугаев, куропаток (Alectoris rufa), цыплят. Экспериментально инфекция была воспроизведена у мышей, гнотобионтных поросят и телят, утят, кроликов, крыс. Естественная инфекция, вызванная C. meleagridis, была описана у собаки. Эти криптоспориди вызывают инфекцию с клиническими признаками и без клинических признаков у людей. У человека C. meleagridis является третьим по распространенности патогеном, вызывающим криптоспоридиоз.
Вирулентность C. meleagridis при экспериментальных усовиях была очень схожа с таковой у C. parvum.
Cryptosporidium baileyi
Вид возбудителя криптоспоридиоза птиц, выделенный в 1986 году от цыплят бройлеров — Cryptosporidium baileyi (Current et al., 1986). Размер ооцист C. baileyi 6.3 х 5.2 μм.
Естественные инфекции, вызываемые C. baileyi, зарегистрированы у многих видов птиц. При этом у птиц могут поражаться как респираторная система, так и кишечник и выделительная система. Соответственно, паразиты обнаруживаются на коньюнктиве, в ротоглотке, в трахее, бронхах, воздушных мешках, в тонком и толстом кишечнике, в слепых кишках, в клоаке, бурсе, почках, мочеточниках. При оральном заражении основные места где развивается паразит это бурса Фабрициуса и клоака. Интратрахеальное заражение ведет к развитию интенсивного паразитоза в респираторной системе.
При инокуляции ооцист непосредственно в конъюнктивальный мешок у некоторых птиц развивался коньюнктивит.
C. baileyi наиболее часто вызывает респираторную форму криптоспоридиоза птиц, сопровождающуюся повышенной заболеваемостью и смертностью. Особенно часто эту форму инфекции регистрируют у цыплят бройлеров. У цыплят при эспериментальной коинфекции с вирусом болезни Марека развивалась почечная форма криптоспоридиоза.
Cryptosporidium baileyi вероятно самый распространенный возбудитель криптоспоридиоза птиц. Паразит поражает большое число разных видов птиц из разных отрядов. В публикациях отмечаются инфекции вызванные C. baileyi у озерных чаек, цыплят, бакланов, канадских и американских журавлей, туканов-ариэлей, ткачей Джексона, индеек, уток, гусей, корелл, бурых перепелов, серобрюхих бюльбюлей, красноспинных черных кассик, африканских страусов, хохлатых оропендул, зеленощеких амазонов, индийских кольчатых попугаев, серых куропаток и у гибридных соколов.
В экспериментальных условиях наблюдалась успешное межвидовое заражение разных видов птиц (например, от уток к индюшкам). Экспериментальное заражение мышей и коз не приводило к развитию инфекции.
Генетически Cryptosporidium baileyi близок к avian genotype I и II.
Cryptosporidium galli
C. galli вид криптоспоридий вызывающих инфекции у птиц был описан Павлюшеком у цыплят (Pavlásek, 1999, 2001). Ооцисты C. galli 8.25 х 6.3 (8.0–8.5 х 6.2–6.4) μм.
В отличии от предыдущих видов криптоспоридий, жизненный цикл этих паразитов протекает в эпителиальных клетках железистого желудка.
В литературе описана также C. blagburni. Современные молекулярные исследования, позволили установить что C. galli и C. blagburni это один и тот же вид криптоспоридий.
Cryptosporidium galli вызывает развитие клинических инфекций у птиц с высокой смертностью.
Гистопатологичекие исследования тканей инфицированных ткачиков выявляют некроз и гиперплазию железистых эпителиальных клеток железистого желудка с большим количеством ооцист прикрепленных поверхности железистых клеток.
Естественные инфекции вызванные C. galli отмечены у расписных астрильдов, цыплят, глухарей, обыкновенных щуров, лазурных травяных попугайчиков, корелл, красных фламинго, доминиканской кардиналовой овсянки, малайских калао, трупиалов, канареек, зебровых амадин, короткохвостых травяных амадин, каштановогрудых амадин (или муний).
Эксперименты установили что ооцисты C. galli выделенные от больных кур были заразительны для 9 дневных цыплят, но не вызывали инфекции у 40 дневных цыплят.
Cryptosporidium avium
Размер ооцист C. avium 5.30–6.90 μм (среднее = 6.26 μм) × 4.30–5.50 μм (среднее = 4.86 μм).
Большинство птиц, инфицированных C. avium включаяя экспериментально зараженных цыплят и волнистых попугайчиков не проявляли никаких клинических признаков криптоспоридиоза, и у них не было выявлено патологий. Разные стадии развития паразита были обнаружены в подвздошной и слепых кишках при электронной сканирующей микроскопии. Однако есть публикация о криптоспоридиозе у 7 летнего какаду Инка (Lophochroa leadbeateri), у этого какаду была сниженна активность (летаргия), отказ от еды, и пролапс клоаки. C. avium была обнаружена в почках, мочеточнике, и в клоаке этого какаду.
Ооцисты выделенные от новозеландских какарики были заразительны для 6 месячных волнистых попугайчиков и для кур. Препатентный период для обоих видов попугаев составил 11 дней. Интенсивность инфекции была мала, с максимумом интенсивности в 5000 ооцист на грамм помета. Микроскопически ооцисты определяли на 12-16 день у кур и на 12 день у волнистых попугаев. Методом ПЦР наличие ДНК C. avium определялось с 11 до 30 дня после инокуляции (на момент окончания эксперимента).
Cryptosporidium avium не вызывал заражения 8 недельных мышей.
Виды птиц у которых обнаружена инфекция вызванная C. avium описанные в публикациях: розовощекие неразлучники (Agapornis roseicollis), венесуэльские амазоны (Amazona aestiva), кореллы (Nymphicus holandicus), волнистые попугаи (Melopsittacus undulates), какаду Инка, новозеландские какарики, куры.
Cryptosporidium proventriculi
C. proventriculi (ранее известные как криптоспоридии avian genotype III) поражают железистый и мускульный желудок птиц разных отрядов, хотя ранее считалось что эти паразиты поражают только попугаев.
В одном из исследований 21 попугая 3х разных видов, C. proventriculi sp. был обнаружен у 57% попугаев, у которых эти криптоспоридии выделялись с пометом с интенсивностью от 2000 до 30000 ооцист на грамм помета. Естественно зараженные кореллы выделяли паразитов на протяжении 5 месяцев. Ни у одной из зараженных птиц не наблюдалась диарея или другие признаки инфекции.
Интенсивность экспериментальной инфекции вазванной C. proventriculi sp. у корелл варьировала от 4000 до 60000 ооцист на грамм помета. У зараженных попугаев не было клинических признаков инфекции, также на 20й день после инфицирования не было патологоанатомических признаков инфекции. Гистологическими методами не удалось обнаружить стадии развития C. proventriculi sp. но электронная микроскопия выявила наличие разных стадий развития среди микроворсинок клеток железистого и мускульного желудков. Патологических изменений не было обнаружено.
В природных условиях и в условиях неволи, по литературным данным, есть и другие естественные хозяева C. proventriculi:
толстоклювый попугай Катерины (Bolborhynchus lineola), синелобый амазон (Amazona aestiva), воробьиные попугайчики или форпусы (Forpus sp.), розовый какаду (Eolophus roseicapilla), канарейки (Serinus canaria), неразлучники (Agapornis sp.), рисовки (Padda oryzivora), красноклювые лазоревые сороки (Urocissa erythrorhyncha), белогрудые туканы (Ramphastos tucanus), конголезкие длиннокювые попугаи (Poicephalus gulielmi), рыжешейные овсянки (Zonotrichia capensis), златогрудые андигены или туканеты (Pteroglossus bailloni), разне виды чаек, солнечные аратинги (Aratinga solstitialis), туканы токо (Ramphastos toco).
Наиболее близкими родственниками этих криптоспоридий, судя по данным генетических исследований, является генотип криптоспоридий выделенных от вальдшнепов (Eurasian woodcock genotype).
Eurasian woodcock genotype
Этот генотип наиболее близок к криптоспоридиями поражающим желудок (C. serpentis, C. muris, C. andersoni). Все эндогенные стадии развития, включая формирование ооцист проходят в железистом желудке птиц. Размер ооцист 7.5 х 6.0 μм. У птиц зараженных этим типом криптоспоридий не было никаких клинических признаков заболевания.
Cryptosporidium parvum.
Этот вид криптоспоридий наиболее частый возбудитель инфекции млекопитающих. Зрелые ооцисты овоидные или сфероидные и не превышают 4.5 μм в диаметре. У млекопитаюших инфекция вызванная C. parvum часто поражает и тонкий и толстый кишечник. В некоторых странах C. parvum является главной причиной развития криптоспоридиоза у человека.
C. parvum не рассматривается как главный возбудитель криптоспоридиоза у птиц, хотя есть много публикаций об обнаружении ДНК C. parvum в помете у ассимптоматических птиц разных отрядов. У попугаев C. parvum был обнаружен у корелл (Nymphicus hollandicus), трех видов воробьиных попугайчиков (Forpus sp.) и у ожерелового попугая (Psittacula krameri).
Атипичный криптоспоридиоз вызванный C. parvum был диагностирован у двух гибридов сапсана и балобана. Инфекция протекала без проявления клинических признаков заболевания. Эндокскопия выявила микроцисты на каудальной поверхности легких и аэросаккулит. Цитологический анализ цист из респираторной системы больных соколов выявил споры плесневых грибков и кислотоустойчивые организмы идентифицированные как криптосоридии. ПЦР помета и биопсионого материала с поверхности легких были положительны на криптоспоридийный ген gp60. Генетическое секвенирование установило видовую принадлежность криптоспоридий к C. parvum с точностью 100% Лечение проведенное в течении 1 месяца было безрезультатным, сокола оставались положительным на криптоспоридий. Через 8 месяцев птицы оставались без клинических признаков заболевания и в хорошей физической форме. Другие сокола находящиеся в этом же хозяйства оствались отрицательными на C. parvum.
У авдоток (Burhinus oedicnemus) были зарегестрированы вспышки кишечного криптоспоридиоза вызванные C. parvum в смешанных экспозициях в Дубае (Zylan et al., 2008).
Cryptosporidium canis.
C. canis была обнаружена в помете у ассимптоматичного ожерелового попугая (P. krameri.). Эту криптосспоридию обнаруживают у людей, частота ее обнаружения у лиц с диареей 0.04% , возможность передачи C. canis от собак к человеку обсуждаеся (Xiao с сотоварищи, 2007), но пока нет однозначного мнения.
Cryptosporidium muris и C. andersoni.
Эти криптоспоридии инфицируют несколько видов млекопитающих и иногда приводят к развитию клинической инфекции. У птиц C. muris и C. andersoni могут обнаруживаться в помете. Пока не известно точно это следствие развития инфекции у птиц или простой механический перенос. Субклиническая инфекция вызванная C. muris у африканских страусов была задокументирована в Китае.
Птичьи генотипы криптоспоридий (Avian genotypes).
Avian genotypes I–IV.
Криптоспоридии птиц типов I-IV были выделены от разных видов птиц. Генетический анализ показал, что хотя генотипы I и II типа наиболее близкородственны C. baileyi они все-же генетически отличаются (99.4% и 97.6% сходства, относительно C. baileyi), и на 98.2% сходны друг с другом, В локусе гена актина генотип I и генотип II птиц демонстрировали только 95,7% и 88,3% сходства с C. baileyi.
У африканских страусов птичий генотип II вызывал развитие клинически выраженного клоацита, бурсита и проктита. Криптоспоридии при этом обнаруживались соотвественно в клоаке, бурсе Фабрициуса и на небольшом протяжении прямой кишки. У африканских страусов импортированных в Канаду зараженность достигала 8,5%.
В экспериментальных условиях после инокуляции ооцист заражения мышей, цыплят, индеек, уток и перепелов не происходило.
Avian genotype IV.
Эти криптоспоридии были обнаружены у японских белоглазок (Zosterops japonicus), содержащихся в неволе. Генетическое сходство с C. galli составило 97.9% . У больных белоглазок наблюдалась диарея и анорексия (отказ от еды).
Размер ооцист 8.25 х 6.3 μм.
Криптоспоридии утинного типа (Duck genotype).
Эти паразиты были обнаружены у американских черных крякв (Anas rubripes), и наиболее родственны генотипам выделенным от гусей I и II типов 96.9–97.5% генетического сходства, соответственно.
У уток эти криптоспоридии вызывают развитие кишечной инфекции с преимущественным поражением энтероцитов тонкого кишечника, однако инфекция протекает без клинических признаков. Также криптоспоридии этого типа были обнаружены у канадских казарок (Branta canadensis).
Криптоспоридии гусиных генотипов I–IV (Goose genotypes I–IV).
У канадских казарок из природы выделены goose genotype I, goose genotype II. О клинических инфекциях вызванных этими возбудители пока не известно.
Видоспецифичность птичьих генотипов криптоспоридий.
Все еще не достаточно информации о видоспецифичности генотипов криптоспоридий птиц. Птичий генотип I (Avian genotype I) был выделен от канареек и от павлинов (Pavo cristatus).
Птичий генотип II (avian genotype II) обнаруживается у африканских страусов и у попугаеобразных. Хотя есть публикации об обнаружении этого генотипа криптоспоридий у кур в Китае. Эксприментальное заражение кур не приводило к развитию инфекции и выделению паразитов с пометом.
Инфекции вызванные птичьим генотипом IV (avian genotype IV) и генотипом евразийского вальдшнепа были описани только однажды у японских белоглазок и у евразийских вальдшнепов, соотвественно.
Утиный генотип (black duck genotype) и гусинные генотипы I — V были описаны только у гусеобразных и скорее всего имеют узкий спектр восприимчивых хозяев.
Распространенность криптоспоридиоза птиц.
Инфекции вызванные криптоспоридиями у разных видов диких птиц и птиц содержащихся в неволе, судя по разным научным публикациям, встречаются с частотой от 0.8 до 56.47%.
В исследовании проведённом в зоомагазинах провинции Хэнань (Китай) методом флоатации криптоспоридии были обнаружено у 8.1% обследованных птиц (было обследовано 434 птиццы 14 разных семейств), при обследовании этих же проб помета (которые были положительны при микроскопии) методом ПЦР было обнаружено что 51.4% образцов криптоспоридий относятся к C. baileyi. 8.6% к C. meleagridis, 14.3% к C.galli, 8.6% к C. proventriculi, 17,1% к Сryptosporidium avian genotype V.
В Бразилии проводили исследование помета канареек. Обследовали 498 образцов помета. Общий положительный результат на Cryptosporidium spp. был в 13,3 %.
В другом исследовании проведённом в Бразилии, 1027 образцов помета от попугаев и воробьиных птиц (из природы и из неволи), было проанализировано методом дуплексной ПЦР в реальном времени. Положительный ответ для C. galli был получен в 56.47% случаях, и С. proventriculi был обнаружен в 2.04% образцов.
В исследованиях кур в США ооцисты криптоспоридий выявлялись в 14,9% случаев.
В исследованиях в Азербайджане — ооцисты криптоспоридий выявлялилсь у 7,9% кур, 12,9% у фазанов, 21.7% у павлинов и перепелов содержащихся вместе.
Устойчивость во внешней среде
Ооцисты криптоспоридий разрушаются под действием ультрафиолета, мало устойчивы к высыханию — данные экспериментов показывают что только 3-5% ооцист остаются жизнеспособными после 2-4 часов высыхания при комнатной температуре.
Но в слое почвы ооцисты хорошо сохраняются. При 4С почвенные ооцисты остаются инфективными длительное время. Ооцисты оставались живыми после промораживания при -10С в течении 168 часов и при -15 в течении суток, при -20С в течении 8 часов.
Ооцисты хорошо сохраняются и распространяются в окружающей среде в микробных биопленках. Это ведет к тому, что ооцисты накапливаются в больших количествах в водных пленках и сохраняют свою заразительность.
Ооцисты хорошо сохраняются в пресной и соленой воде при большом диапазоне температур. Fayer со тововарищи в своих исследованиях выяснил, что ооцисты сохраняют инфективность при 20С в течении 13 недель при соленности от 0 до 10 ppt, 4 недели при 20 ppt и 2 недели при 30 ppt.
Устойчивость к дезинфектантам.
Ооцисты криптоспоридий устойчивы к хлорке и без фильтрации их очень сложно удалить из питьевой воды. Двух часовое замачивание в 6% растворе хлорки снижает количество жизнеспособных спор до 92,7%. Растворы хлоро-крезола более эффективны.
В лабораторных условиях ооцисты оставались живыми месяцами при при хранении при 4С в 2.5% растворе дихромата калия. Также ооцисты оставались жизнеспособными при при 10-15 минутном инкубировании в 25% растворе хлорки (гипохлорид натрия).
Инкубация ооцист C. baileyi в течении 30 минут при комнатной температуре в 9 наиболее распространенных дезинфектантах при максимально рекомендованных производителями концентрациях имело либо очень небольшой цидный эффект, либо не имело эффекта вовсе. Инкубация в 50% растворе аммиака привела к наибольшему снижению эксцистастации. Замачивание в 50% растворе хлорки привело к разрушению большинства ооцист.
Уборка должна включать в себя максимально возможное механическое удаление всех загрязненных материалов.
Для обработки лабораторных клеток наиболее эффективным оказалась обработка паром, ооцисты разрушались при температуре выше 65С.
Профилактика и контроль.
В настоящее время не существует однозначно эффективных антикриптоспоридиозных препаратов или вакцин. Лечение в большинстве случаев, все еще является экспериментальным.
Дезинфекция и обычные санитарные меры полезны, но не существует разработанных протоколов которые можно рекомендовать как эффективный алгоритм.
Диагностика.
Для диагностики криптоспоридиоза птиц пригодны: помет, мазки из клоаки, мазки из трахеи, смывы из трахеи, смывы и мазки из воздушных мешков, смывы из ноздрей, смывы с коньюнктивы, мазки отпечатки с поверхности эпителия железистого желудка, кишечника, трахеи, бронхов, воздушных мешков.
Хорошую эффективность для диагностики криптоспоридиоза в полевых условиях показало применение смоченных физраствором зондов с хлопоковыми аппликаторами. Активные движения аппликатором в трехее или в клоаке позволяют отделять ооцисты с поверхности эпителия. Мазки помещаются в пробирку с 1 мл воды или фиксирующего раствора для транспортировки в лабораторию.
Для лабораторной диагностики образцы помета или лаважная жидкость из респираторной системы, могут доставляться в лабораторию в свежем виде, в 10% растворе формалина, или в водном 2.5 % растворе дихромата калия.
Ооцисты выделяются не периодически, поэтому для повышения вероятности обнаружения паразитов, рекомендуется сбор помета в течении трех дней.
Для концентрации ооцист применяются методики флоатации в растворе сахарозы или в перенасыщенном солевом растворе, или применяется формол-эфирный метод Аллена и Ридли.
Для повышения вероятности выделения гастротропных криптоспоридий предпочтительно делать смыв из желудка а не исследовать помет, и наоборот для криптоспоридий находящихся в кишечнике, в помете их больше чем на слизистой кишечника.
Цитологический метод.
Обнаружение ооцист криптоспоридий в нативном материале производится при применении темнопольной микроскопии или фазового контраста, окрасками для выявлении кистолоустойчивости, негативными окрасками (например, негативная окраска малахитовым зеленым), или флюоресцентной микроскопией для которой применияется окраска аурамином-О. Эти методики позволяют легко дифференцировать ооцисты криптоспоридий от дрожжей (Candida spp.) или бластоцист (Blastocystis spp.).

C. proventriculi в препарате помёта попугая кореллы. Негативная окраска малахитовым зелёным. Увеличение 1000. Источник: Ocorrência de cryptosporidium spp. em psitacídeos exóticos mantidos em cativeiro nas regiões sul e sudeste do brasil: avaliação de métodos de diagnóstico e classificação molecular. Elís Domingos Ferrari.
Диагностика криптоспоридиоза затруднена из-за маленьких размеров паразитов и из-за того, что они жестко прикреплены к микроворсинкам эпителиальных клеток. Крошечные ооцисты меньше кокцидий и не содержат контрастных внутренних структур, поэтому их легко пропустить при световой микроскопии и в гистологических срезах. Для анализа свежих мокрых препаратов необходимо использовать фазовый и интерфереционный контраст.
Самый быстрый, дешёвый и часто применяемый метод диагностики это обнаружение ооцист во флоатате раствора Шизера после центрифугирования и последующая фазово-контрастная микроскопия или светлопольная микроскопия.
Для окраски ооцист и разных стадий развития криптоспоридий в цитологических препаратах пременяются стандатные методики окрашивания гематоксилин/эозином и дополнительные методики окрашивани сафранином-метиленовым голубым, окраски для выявления кистооустойчивых организмов или иммуногистохимические методы окрашивания.
Размер ооцист от 2 до 6 нм, в нативных мазках стенка ооцист прозрачна или светлоголубая. Стенка ооцист всех форм толшиной 0.5μm, прозрачна и не содержит микропиле. Исследование не окрашенных препаратов лучше проводить при большом увеличении применяя фазовый контраст. При окраске по методам близким к методике Романовского (например при окраске по Райту-Гимзе) выявляются темно синие гранулы во внутренней структуре ооцист. При окраске по методу Циля-Нильсена криптоспоридии окрашиваются в ярко красный или розовый цвет, что позволяет легко их дифференцировать от дрожжей.

Ооцисты криптоспоридий в препарате помёта птиц. Характерный внешний вид при окраске модифицированным методом Циля-Нильсена — фото а, увеличение 1000. Морфология ооцист при дифференциальной интерференционно-контрастной микроскопии фото b, увеличение 1000. Источник: Cui, Z., Song, D., Qi, M. et al. Revisiting the infectivity and pathogenicity of Cryptosporidium avium provides new information on parasitic sites within the host. Parasites Vectors 11, 514 (2018). https://doi.org/10.1186/s13071-018-3088-x
Зафиксированные в формалине ооцисты криптоспоридий не окрашиваются положительно по Цилю-Нильсену.
Пример цитологической диагностики криптоспоридий. Видео окрашенного препарата для выявления микроорганизмов с кислотоустойчивыми тинкториальными свойствами, увеличение 1000, маслянная иммерсия, модифицированная окраска по Киньону:
Микроскопия имеет малую чувствительность, требует много времени и большого опыта микроскописта. При малом количестве ооцист в образце возможны ложно-отрицательные результаты. При развитии хронической инфекции вызванной C. galli в окружающую среду выделяется очень малое количество ооцист, поэтому на стекле после флоатации и окрашивания может быть единичное количество ооцист, что затрудняет их обнаружение. Точно также количество выделяемых в окружающую среду ооцист варьирует при развитии инфекций вызванных C. baileyi и C. meleagridis, кроме того, число ооцист выделяемых с пометом зависит от возраста птицы и от видовых особенностей птиц.
Видовая индентификация криптоспоридий на основе морфологических признаков не возможна, поэтому для определения вида после цитологического обнаружения паразитов необходимо применение более специфичных методов диагностики.
Гистологический метод.
Разные стадии развития криптоспоридий в слизистых желудочно-кишечного тракта, респираторной и выделительной систем хорошо визуализируются при окраске гистопрепаратов гематоксилином и эозином, они видны как базофильные тельца 2-6 μm на апикальной поверхности эпителиальных клеток среди микроворсинок. Примеменение окраски по Цилю-Нильсену или другими методиками для обнаружения кистолоусточихвых микроорганизмов позволяет контрастировать ооцисты и дифференцировать паразитов от других протозойных возбудителей болезней птиц.

Гистологический препарат фабрициевой бурсы курицы с инфекцией, вызванной C. avium. Окраска гематоксилин/эозином, криптоспоридии на поверхности эпителиальных клеток. Фото a и b, увеличение 1000, криптоспоридии указаны стрелками; и сканирующая электронная микроскопия этой же локации фото с — f. Источник: Cui, Z., Song, D., Qi, M. et al. Revisiting the infectivity and pathogenicity of Cryptosporidium avium provides new information on parasitic sites within the host. Parasites Vectors 11, 514 (2018). https://doi.org/10.1186/s13071-018-3088-x
Хотя ооцисты некоторых видов криптоспоридий обладают различиями в морфологии и морфометрии, но микроскопия не позвозволяет проводить видовую идентификацию разных видов и генотипов криптоспоридий из-за малых вариаций отличительных признаков.
Электронная микроскопия.
Из-за малого размера разных стадий развития криптоспоридий для обнаружения паразита в тканях применяется и электронная микроскопия. При малом количестве выделяемых в окружающую среду ооцист это единственная возможность обнаружения паразитов.
ИФА.
После инфицирования в крови птиц образуются специфичные антитела, которые можно обнаружить методами ИФА или другими иммунологическими тестати. Также антитела методом ИФА можно обнаружить в нативном помете и смывах из респираторной системы. Чувствительность диагностики методом ИФА сравнима с ПЦР.
В продаже доступны быстрые тесты прямого обнаружения флюоресценцирующих антител (DFA) и иммуноферментный анализ (EIA).
В продаже доступны наборы для экспресс диагностики криптоспоридиоза, которые хорошо себя зарекомендовали на практике. Например, наборы RIDA Quick cryptosporidium/Giardia Combi — комбинированные экспресс-тесты для быстрого качественного определения антигенов Cryptosporidium parvum и Giardia lamblia в образцах кала человека. Эти наборы хорошо определят наличие криптоспоридий и лямблий и в помете птиц.
Также существуют экспресс-тесты для обнаружения методом прямой флуоресценции и имууноферметным анализом которые выпускаются для комплексной диагностики лямблий, криптоспоридий и дизентерейной амебы (Entamoeba histolytica). Тесты дешёвы и могут применяться в рутинной практике птичьего врача без специальной подготовки. Но результат иммуноферментного анализа может быть ложноположительным, это необходимо учитывать при интерпретации!
В клинической практике удобна количественная оценка антигенов в помете, которая делается в некоторых ветеринарных лабораториях, при этом есть явная корреляция между количеством паразитов в клиническим состоянием птицы в процессе лечения.
ИФА (ELISA) и метод прямой флуоресценции антител (DFA) более чувствительны и специфичны чем микроскопия. Метод прямого обнаружения флюоресцирующих антител применяется для обнаружения криптоспоридий в помете, воде, еде. Но большая вариабельность эпитопов на стенке цист делает этот метод анализа малоспецифичным и низкочувствительным (по сравнению с другими методами диагностики).
Так как существует кросс-реакция связывания антигенов криптоспоридий разных видов, ИФА и метод прямой флуоресценции антител не являются видоспецифичными анализами. Т.е. установить какой именно вид криптоспоридий вызывает инфекцию этими методами нельзя. Но оба этих методов разработанные для обнаружения антигенов C. parvum хорошо выявляют антигены других криптоспоридий, вызывающих инфекции у птиц.
ПЦР.
Диагностика методом ПЦР, теоретически, позволяет обнаружить единичную ооцисту в исследуемом образце. Чувствительность ПЦР, в среднем, в 2 раза выше чем цитологическая диагностика, но надо учитывать что из-за высокой специфичности и большого количества видов криптоспоридий у птиц, возможны ложноотрицательные результаты ПЦР. Поэтому нобходимо делать ПЦР применяя общеродовые праймеры для Cryptosporidium spp.
Обнаружение ДНК в помете зависит от эффективности выделения генетического материала, а этот процесс затруднен наличием жесткой каспулы ооцисты, поэтому требуется дополнительные шаги при пробоподготовке с помощью химикатов, стеклянных шариков, циклов заморозки и разморозки или кипячения.
Дуплексная ПЦР в реальном времени более чувствительная чем гнездовая ПЦР для обнаружения желудочных криптоспоридий.
Культивирование в куриных эмбрионах.
При инокуляции куриных эмбрионов ооцистами C. baileyi и C. parvum — криптоспоридии активно развиваются в тканях эмбрионов, этот метод является основным методом получения криптоспоридий в лабораториях.
После вылупления у зараженных цыплят наблюдалось клиническое течение инфекции. Инфекционная доза не имела влияния на тяжесть инфекции. Цыплята зараженные эмбрионами выделяли ооцисты сразу же поле вылупления, и выделяли их в значительно большем количестве на всем протяжении инфекции чем зараженные однодневные цыплята.
У цыплят зараженных на стадии эмбриона C. baileyi обнаруживали во всех органах за исключением головного мозга. C. parvum обнаруживались только в желудочно-кишечном тракте и в трахее. У цыплят зараженных в суточном возрасте C. baileyi обнаруживали только в желудочнокишечном тракте и в трахее. Цыплята зараженные на эмбриональной стадии погибали в 16 дневном возрасте. Цылята зараженые в суточном возрасте выздоравливали и далее не выделяли ооцисты.
Сравнение методов диагностики.
В исследованиях проведённых для сравнения диагностической чуствительности разных методов диагностики выявлено что имммунофлюоресцентная микроскопия и ПЦР превосходят по чувствительности иммуноферментные методы исследования и флуюресцентные окраски, которые в свою очередь более чувствительны чем окраска для выявления кислото-устойчивых микроорганизмов (окраска по Цилю-Нильсену, по Киньону и др) и иммунохроматографичесикие анализы (ИХА).
Специфичность микроскопии зависит, главным образом, от опыта микроскописта в различении ооцист от других структур в мазках окрашенных без применения специфичных методик и флюоресцентных красителей. Иммунофлюоресцентные окраски дают большую специфичность.
Выбор метода диагностики зависит от имеющихся в лаборатории возможностей и компетенций диагностов.
В ряде исследований, некоторые образцы помета бывшие отрицательными при микроскопии были положительны при ПЦР анализе, все положительные по ПЦР образцы были положительны и при микроскопии, при этом в этих образцах были единичные ооцисты криптоспоридий. Так как инфекция вызванная желудочными криптоспоридиями у попугаев протекает с малым выделением ооцист с пометом, то при использовании для диагностики только микроскопиюи возможны ложно-отрицательные результаты.
Причинами ложно-отрицательных результатов ПЦР может быть множество факторов, таких как малое количество ооцист в помете птиц больных желудочным криптоспоридиозом или действие ингибиторов ПЦР. Об ингибиторах ПЦР подробно рассказывается в вебинаре по клинической микробиологии.
Так как криптоспоридии прикреплены к поверхности эпителия, более валидные результаты анализов можно получать при вскрытии свежих трупов, при этом делаются мазки из нескольких участков кишечного тракта, и у гусиных делают мазки из почек.
Для птиц, у которых серьезная иммунокомпромиссная ситуация (например развивается вирусная инфекция, системый микоз и/или микобактериоз) более эффективными для обнаружения криптоспоридий могут альтернативные методы забора материала, например эндогенные стадии развития криптоспоридий могут быть обнаружены на гистологических препаратах биопсийоного материала кишечника или других локаций.
Патогенез.
Знание о тропизме какого-то вида криптоспоридий важно для предсказания патологий и диагностики заболеваний. Лаваж желудка более эффективен для обнаружения гастротропных паразитов, чем анализ помета или исследования мазков из зоба. И напротив для видов тропных клоаке. Гастротропные паразиты чаще вызывают патологии сопровождающиеся снижением аппетита, потерей веса, хронической рвотой. Энтеротропные криптоспоридии в основном ассоциированы с потерей веса и диареей. Криптоспоридии тропные к мочевыделительным путям вызывают развитие подагры и почечной недостаточности. Криптоспоридии тропные к респираторному эпителию вызывают развитие отитов, болезни глаз, болезни органов дыхания.
Криптоспоридии в норме не вызывают развитие системной инфекции и не проникают глубоко в ткани, чаще всего паразиты располагаются под поверхностной мембраной эпителиальных клеток на апикальной поверхности кишечного эпителия. Но это приводит к серьезным нарушениям абсорбции питательных веществ и секреции. Эти изменения могут быть результатом прямого повреждения эпителиальных клеток хозяина или это может быть следствием развития воспалительной реакции, которая развивается в месте внедрения паразита.
До настоящего времени не обнаружено специфического фактора вирулентности криптоспоридий, это связано с тем, что в отличии от других протозойных патогенов таких как токсоплазмы и плазмодии, культивировать криптоспоридии in vitro довольно сложно, и нет техники выборочного включения или выключени генов ответственных за транскрибцию разных факторов патогенности.
Предполагаемый фактор вирулентности криптоспоридий это гены отвественные за начальные стадии взаимодействия ооцист и спорозоитов с эпителиальными клетками хозяина, включая эксцистацию, скольжение по поверхности эпителия, прикрепление, внедрение, формирование паразитофорной вакуоли, поддержание внутриклеточного гомеостаза и повреждение клетки хозяина.
C. parvum — паразит поражающий большое число видов, в то время как С. hominis поражает только человека, другие виды криптоспоридий имеют определенный спект хозяев, который может включать и человека, некоторые виды криптоспоридий рассматриваются как оппортунисты. Все это может быть результатом наличия генетически обусловленных факторов патогенности, которые позволяют одним видам паразитов внедряться в клетки специфичных хозяев.
Задокументировано повреждение клеток в монослое энтероцитов, которое сопровождалось разрывом межлекточных соединений, потерей барьерных функций эпителия, выделение лактатдегидрогеназы и повышенной частотой гибели клеток. Механизм вызывающий повреждение клеток при криптоспоридиозе остается не выясненым.
У птиц с иммунодефицитными состояниями ограниченная инфекция становится жизнеугрожающей. В исседованиях на лабораторных животных доказано, что криптоспоридиоз ускоряет развитие истощения и что у истощенных мышей криптоспоридиоз протекает в более тяжелой форме.
Ооцисты из помета загладываются птицей спорозоиты внедряются в эпителий клоаки и бурсы. Респираторная инфекция развивается как результат ингаляции или аспирации ооцист из пыли. В экспериментальных условиях кишечная форма инфекции развивается при заглатывании 100 ооцист, при аспирировании этого же количества ооцист развивается респираторная инфекция. Ооцисты C. baileyi инфективны к моменту их выделения с пометом и для перезаражения не требуется промежуточных хозяев. Так как C. baileyi заражают большое количество разных видов птиц — больные птицы могут быть переносчиками инфекции. Так как C. baileyi не заражают млекопитающих, грызуны и насекомые могут быть механическими переносчиками паразитов.
В публикациях, наиболее часто упоминаемыми клиническими признаками связанными с криптоспоридиозом являются растройства работы ЖКТ и дыхательной системы иногда ассоциированные с гибелью птиц. Но при исследовании субклинического течения инфекции обнаружена колонизация криптоспоридиями бурсы Фабрициуса, коньюнктивы, среднего уха, поджелудочной железы и почек.
Не значительные и явно выраженные клинические признаки поражения ЖКТ и дыхательной системы замечают на третий день после инокуляции ооцист. Кишечная форма инфекции обычно протекает в легкой форме.
Признаки респираторной инфекции могут появляться в течении первой недели после внутритрахеального введедении ооцист C. baileyi 7-9 дневным цыплятам бройлерам, иногда с большой заболеваемостью и сметностью. Оральная инокуляция 4×105 ооцист приводила только к асимптоматической кишечной инфекции.
Такие признаки респираторной инфекции как чихание и кашель развивались у большинства цыплят которым в шестидневном возрасте ооцисты инокулировали интратрахеально. Наиболее выраженные признаки у птиц развивались на 12й день после инокуляции, большинство птиц вытягивали шею чтобы сделать вдох. Такая картина наблюдалась на протяжении 3-4 недель после инокуляции, а потом постепенно признаки респираторных проблем сходили на нет. У птиц с респираторной инфекцией наблюдалось снижение набора веса, а у птиц с желудочно-кишечной инфекцией снижение набора веса не было. Цыплята в возрасте 28 дней были более устойчивы к развитию инфекции чем в возрасте 7-14 дней.
После инокуляции ооцист в трахею может развиваться аэросаккулит и пневмония, самый раний срок развития этих патологий 6 дней, но чаще они развиваются в период 12 — 28 дней после инокуляции. В начале развития аэросакулита стенка передних грудных воздушных мешков утолщается, в просвете мешков скапливается пенистый, прозрачный или беловатый жидкий экссудат. К 12-му дню стенка воздушных мешков может стать очень толстой а экссудат сновится казеозным. Легкие птицы больной аэросаккулитом, почти всегда, поражаются, в них образуются очаги и области сливной пневмонии, которые затрагивают от 10 до 80% объема легких, преимущественно в вентральных областях. Абдоминальныые воздушные мешки могут также вовлекаться в процесс развития инфекции.
Гистологические исследования птенцов, которым ооцисты инокулировали интратрахеально выявляют большое количество паразитов среди микроворсинок эпителия выстилающего трахею и бронхи. На 4й день после инокуляции реснички утеряны и замещены развивающимися паразитами. К 12му дню почти все реснички замещаются разными стадиями паразитов — это нарушает механизм перемещения слизи из бронхов и трахеи. Гистологически выявлятся очаги гиперплазии эпителиальных клеток, утолщение слизистой и инфильтрация слоя мононулеклеарных клеток гетерофилами, потеря ресничек, и скопление слизи в дыхательных путях. Третичные бронхи и атрии легких заполнены слизью смешанной со слущенными эпителиальными клетками, лимфоцитами, макрофагами и паразитами.
Взаимодействие C. baileyi и других возбудителей респираторных инфекций приводит к тому, что повышается вероятность развития респираторного эшерихиоза, так как нарушается механизм транспорта слизи ресничным эпителием. У цыплят вирус инфекционного бронхита и кишечная палочка усиливают тяжесть протекания респираторной инфекции вызванной C. baileyi.
Препатентный период.
Препатентный период для C. avium 12 дней, что значительно больше чем для С. meleagridis и C. baileyi ( 4-8 дней ) и короче чем у C. galli у которых этот период составляет 25 дней. Препатентный период для C. proventriculi — 6 дней после инокуляции. Разница в длине препатентного периода обычна для разных видов криптоспоридий, даже для близкородственных у одного и того же хозяина. Например, C. bovis и C. ryanae паразитируют у КРС имеют генетическое сходство в 98% но у C.ryanae препатентный период 11 дней, а у C. bovis — 16 дней.
Длительность инфекции.
Не смотря на то, что инфицированная C. avium птица выделяла ооцисты в малом количестве, выделение было постоянным на протяжении всего времени эксперимента (30 дней) и у естественно инфицированных какарики выделение было постоянным на протяжении как минимум, 5 месяцев, далее просто перестали мониторить ситуацию. Длящаяся несколько месяцев инфекция также наблюдалась у различных воробьиных птиц пораженных C. galli. Задокументирированный период инфекции для C. baileyi и C. meleagridis варьировал от 4 дл 151 дня и от 4х до 21 дня соответственно, в зависимости от вида и возраста хозяина.
У иммунокомпромиссных попугаев, персистирующая форма инфекции длится годами приводит к истощению и алиментарной недостаточности.
Вторичные инфекции.
Хронически больные птицы страдают иммуносупрессией и предрасположены к развитию вторичных инфекций. Такими вторичными инфекциями часто являются криптоспоридиоз, грибковые инфекции (системные микозы), бактериальные инфекции вызванные кишечной палочкой, стафилококками, клебсиеллами, синегнойной палочкой и пр.). Среди протозойных возбудителей наиболее частым патогеном вызывающими развитие сопутствующей инфекции являются криптоспоридии. Бурсальный криптоспоридиоз наиболее часто встречается у птиц больных цирковирусом (PBFD), болезнью Марека. Желудочно-кишечный криптоспоридиоз часто развивается у птиц больных микобактериозом.
Видео о криптоспоридиозе у выкормыша краснохвостого жако с цирковирусной инфекцией:
Энтерит.
Кишечный криптоспоридиоз у цыплят, вызываемый C. baileyi может протекать с изъязвлением слизистой клоаки и бурсы, но обычно, такие изъязвления носят ограниченный характер. Но в некоторых публикациях предполагается что такие поражения кишечника могут серьезно влиять на прирост живой массы бройлеров. Среди экспериментальное зараженных цыплят с пораженной C. baileyi бурсой была более высокая смертность по сравнению с контрольной группой.
Кишечная форма криптоспоридиоз у птиц протекает с утолщением слизистой кишечника, чрезмерным образованием слизи, лифмоплазматическим и гистиоцитарным воспалительным процессом. Сопутсвующие коинфекции вторичными патогенами в качестве которых, чаще всего выступают кандиды (Candida spp.) кишечная палочка (Escherichia coli), сальмонеллы (Salmonella spp.) и вирусные патогены. Это приводит к усилению диареи.
Cryptosporidium avium был инфекционен для цыплят и для волнистых попугайчиков. Ооцисты микроскопически обнаруживали на 12 день после заражения у цыплят и у волнистых попугаев. У цыплят их обнаруживали на 12-16 день, у попугайчиков на 12й день после заражения. У обоих видов птиц интенсивность инфекции вызванной C. avium была низкой. Цыплята выделяли в окружающую среду 2000-5000 ооцист в грамме помета, а попугаи не более 2000 ооцист в грамме помета. ДНК C. avium была обнаружена в помете и цыплят и волнистых попугаев на 11 день после заражения и далее обнаруживалась с перерывами до конца эксперимента. У зараженных птиц не было клинических признаков инфекции. У эвтанированных на 20й и 30й день после заражения цыплят и волнистых попугайчиков не было макроскопических признаков криптоспоридиоза. Гистологически не было обнаружено разных стадий развития криптоспоридий ни у цыплят, ни у попугайчиков. Но сканирующая электронная микроскопия выявила наличие паразитов в разных стадиях развития среди микроворсинок в подвздошной и слепых кишках цыплят и в подздошной кишке попугайчиков. При этом не было сопутствующих патологических изменений.
Есть исследования, в которых разные стадии развития C. avium были обнаружены в тощей и слепой кишках птиц, что говорит о широкой степени тканевого тропизма паразита, что сходно с таковым у C. baileyi и avian genotype II.
Болезни глаз.
Разные виды криптоспоридий, и в частности C. baileyi часто являются возбудителями инфекций респираторного тракта, среднего уха и коньюнктивы у диких птиц. Есть публикации о криптоспоридиозном коньюнктивите у сплюшек (Otus scops), белолобых горных ласточек (Petrochelidon pyrrhonota), соколов (гибриды Falco cherrug и Falco rusticolus X Falco cherrug), и у домашних птиц: цыплят, гусей, индюшек, уток, павлинов, фазанов.
Респираторная форма.
Некоторые исследователи (например, Goodwin с сотоварищи) обнаружили что респираторный криптоспоридиоз C. baileyi широко распространен у бройлеров на птицефабриках северной Джорджии. Предрасполагающие к развитию респираторного криптоспоридиоза факторы не изучены, поэтому остаются загадкой вспышки инфекции с большой смертностью и заболеваемостью, и сопровождающее их снижение набора живого веса птицы и повышение соотношения потребляемого корма и наборанного веса. Суммарная распространенность респираторного и кишечного криптоспоридиоза у бройлеров колеблется от 2,8% до 40% от общего поголовья кур на птицефабриках.

а. Диспное у цыплят после интратрахеальной инокуляции ооцист C. baileyi.
b. Гистологический препарат трахеи больного цыплёнка. Стрелками показаны разные стадии развития криптоспоридий на эпителиальной повехности. Эпителиальная гиперплазия и инфилттрация воспалительных клеток в подслизистую. Окраска гематоксилин/эозином, увеличение 400.
с. Гистологический препарат лёгкого цыпленка. Стрелками показаны разные стадии развития криптоспоридий, прикрепленные к эпительной поверхности бронхов. Воспалительныые клетки инфильтрируют подслизистую и эпителий, воспалительный экссудат заполняет просвет бронхов. Окраска гематоксилин/эозином, увеличение 200.
d. Сканирующая электронная микроскопия эпителия трахеи выявляет значительную потерю ресничек и сопуствующию C. baileyi инфекцию, вызванную кишечной палочкой. Стрелкой показана криптоспоридия, стрелкой-указателем показана E.Coli. Увеличение 2000.
Источник: Cryptosporidium infections in birds — a review. Nakamura AA, Meireles MV. Rev Bras Parasitol Vet. 2015; 24:253–267. doi:10.1590/S1984-29612015063
Атипичный криптоспоридиоз, вызванный Cryptosporidium parvum у сокололиных задокументирован в публикации из Саудовской Аравии. У двух гибридных соколов (гибриды кречета и сапсана) без клинических признаков болезни во время ежегодной диспансеризации при эндоскопии выявили наличие микроцист на на каудальной поверхности легких, а также слипчивые изменения в воздушных мешках. Цитологический анализ цист выявил споры грибков и кислотоустойчивые микроорганизмы идентифицированные как криптоспоридии. Ткани легких и помет были обследованы методом ПЦР. Для ПЦР был использован праймер для гена gp60. Секвенирование локуса гена gp60 выявило 100% гомологию с C. parvum. После 1 месяца лечения не было замечено изменений в учатках поражения, но через 8 месяцев после проведенного лечения птицы были в хорошей физической и летной форме. У других птиц этого же хозяина C. parvum не был обнаружен.
Ринит, Синусит.
Синусит как осложнение респираторного криптоспоридиоза описан у индюшек, цыплят, перепелов, домашних гусей, у которых, были также поражены, фабрициева бурса, кишечник, клоака, коньюкнтива, подглазничные синусы, трахея, у этих птиц отмечалась эпителиальная гиперплазия, и очаги лимфоцитарной и гетерофильной инфильтрации в собственную пластинку (lamina propria) сходные с наблюдаемыми при микоплазмозе.
У сплюшек из природы и у соколов разведенных в неволе респираторный криптоспоридиоз вызванный C. baileyi протекал с развитием коньюнктивита и ринита.
Развитие конкурентной инфекции вызванной микоплазмами и криптококками частая ситуация у птиц. У японских перепелов описана инфекция вызванная M. gallisepticum и Cryptosporidium spp. в этом случае, воспаление сопровождалось фоликулярной лимфоидной гиперплазией периокулярных респираторных тканей, и это было схоже с клиническими признаками описанными у ласточек береговушек.
Гастрит, провентрикулит.
Cryptosporidium galli единственная хорошо изученная криптоспоридия птиц вызывающая развитие жедудочной формы криптоспоридиоза. В отличии от криптоспоридий млекопитающих поражающих желудок и не приводящих к значительной заболеваемости и смертности животных, C. galli вызыает у птиц инфекцию со значительной заболеваемостью и смертностью.
C. proventriculi — также поражает желудки птиц. Равич с коллергами в исследовании проведенном в 2014 году показал что желудочный и преджелудочный (развивающийся в железистом желудке) криптоспоридиоз был обнаружен у 31 птицы на вскрытии и 10 из этих птиц криптоспоридии были причиной гибели. У двух птиц удалось идентифицировать выявленных криптоспоридий как C. proventriculi. C. proventriculi — мог быть причиной гибели у этих птиц, но и инфекция вызванная другими видами криптоспоридий не может быть исключена. Макито с коллегами в 2010 году описал клинические признаки желудочно-кишечного криптоспоридиоза: хроническая рвота, кровь в помете (мелена), потеря веса у 20 из 37 розовощеких неразлучников заразившихся C. proventriculi. На рентгене у 16 из 20 птиц с выраженными клиническими признаками был увеличен объем перешейка между железистым и мускульным желудком и утолщена стенка железистого желудка.
Вскрытие и гистологический анализ тканей трех погибших птиц выявили увеличение объема железистого жедудка и перешейка между железистым и мускольным желудком, гипертрофию эпителия железистого желудка — которая была видна на боковой проекции при рентгенологическом исследовании. Прогрессирующее истощение и значительная атрофия грудного мускула наблюдалась у всех трех птиц. Гистологически выявлена экстенсивная гиперплазия эпителия выводящих протоков желёз железистого желудка.
Аналогичные изменения наблюдал Благбурн в 1990 и Морган с коллегами в 2001 в случае инфекции вызванной C. galli у брилиантовых амадин и у других ткачиков пораженных C. proventriculi.
Cryptosporidium galli инфицирует несколько видов птиц отрядов: птицы-носороги (Bucerotiformes), курообразные (Galliformes), воробьинообразные (Passeriformes), фламингообразные (Phoenicopteriformes), попугаеобразные (Psittaciformes). У попугаев желудочный криптоспоридиоз зарегестрирован у корелл, неразлучников, форпусов.
Потогенность криптоспоридий вызывающих развитие гастрита не определена окончательно. Желудочная инфекция вызванная C. galli может протекать субклинически или с проявлением апатии, диареей, потерей веса и внезапной гибели.
Инфекция C. galli характеризуется периодическим или хроническим выделением ооцист с пометом. C. galli инфицируют как птенцов так и взрослых птиц и вызывают хроническую желудочную инфекцию (гастрит) схожий с тем что вызывает C. serpentis у змей. Некоторые исследователи предполагают что хронический провентрикулит у птиц предрасполагает к развитию вторичных инфекций вызванных другими патогенами.
Есть одна публикация об инфекционном провентрикулите у вальдшнепов (Scolopax rusticola) вызванном генотипом Eurasian woodcock. Инфекция протекала у диких вальшнепов находящихся в карантине и приведшая к гибели этих птиц.
Видео о криптоспоридиозном гастрите и провентрикулите у цыплят, ассоциированном с микобактериозом и кампилобактериозом:
Клоацит, бурсит.
Первая публикация о криптоспоридиозе у не домашных птиц, касалась криптоспоридиоза вызванного Cryptosporidium baileyi у краснолобых амазонов (Amazona autumnalis). Эти паразиты часто размножаются в клоаке птиц. Другие виды криптоспоридий чаще поражают кишечник и дыхатальную систему.
После орального или интратрахеального инфицирования C. baileyi солонизирует Фабрициеву бурсу, что приводит к легкой гиперемии и повышенной продукции слизи, развивается экссудация как следствие воспалительной реакции, экссудат содержит гетерофилы, плазму, клеточный детрит. Со временем экссудация приводит к отложению казеозного материала в просвете бурсы.

а. Казеозный экссудат, заполняющий просвет фабрициевой бурсы цыплёнка инфицированного C. baileyi.
b. Сканирующая электронная микроскопия фабрициевой бурсы цыпленка инфицированного C. baileyi. Массивный паразитоз, различные стадии развития криптоспоридий покрывают эпителиальную поверхность бурсы. Увеличение 700.
с. Гистологический препарат бурсы цыплёнка. Разные стадии развития криптоспоридий прикреплены к эпителиальной поверхности, гиперплазия эпителия и инфильтрация воспалительных клеток в подслизистую и слизистые оболочки. Окраска гематоксилин/эозином. Увеличение 400.
d. Гистологический препарат уродеума африканского страуса. Различные стадии криптоспоридий Cryptosporidium avian genotype II прикреплены к эпителиальной поверхности. Инфильтрация воспалительных клеток в слизистую и подслизистую. Окраска гематоксилин/эозином. Увеличение 400.
Источник: Cryptosporidium infections in birds — a review. Nakamura AA, Meireles MV. Rev Bras Parasitol Vet. 2015; 24:253–267. doi:10.1590/S1984-29612015063
У африканских страусов криптоспоридиоз может приводить к выпадению (пролапсу) фаллоса и клоаки, а также приводить к развитию некроза поджелудочной железы. Криптоспоридии второго птичьего генотипа (avian genotype II) у страусов чаще колонизируют эпителий клоаки и реже прямой кишки и фабрициевой бурсы что приводит пролапсу клоаки и иммуносупрессии. Криптоспоридиоз у страусов чаще развивается при содержании птиц в плохих условиях с нарушением правил гигиены.
У утят средних крохалей (Mergus serrator) в берлинском зооботсаде криптоспоридиоз вызванный C. baileyi протекал поражением фабрициевой бурсы. Утята не могли нормально есть, развивалась анемия, истощение. Количество криптоспоридий в бурсе было разным от небольшого до очень большого, наличие паразитов ассоциировалось с развитием гиперплазии, дегенерации и слущиванием эпителия, также развивался гетерофильный бурсит — который отмечают при криптоспоридиозе и у других видов птиц. Лимфоидная ткань практически отсутствовала. Источником инфекции могли быть утята кряквы (Anas platyrhynchos) которых подсаживали к утятам крохалей для минимализации стресса, или взрослые кряквы к которым подкладывали яйца крохалей для высиживания.
Нефрит.
Почечный криптоспоридиз был зарегестрировал у нескольких видов птиц, чаще всего он встрачается у водоплавающих. При этом необходимо проводить дифференциальную диагностику от токсоплазмоза.
Криптоспоридиальная инфекция мочевыделительного тракта описана у цыплят (Gallus gallus domesticus), короткохвостых травяных амадин (Poephila cincta), джунглевых кур (Gallus sonneratii) и у какаду Инка — патогенез заболевания у этих птиц был одинаковым.
Заболевания иммунной системы.
C. baileyi поражает фабрициеву бурсу, которая является основным органом отвечающим за гуморальный иммунитет у птиц. В условиях экспериментального заражения цыплят C. baileyi развивался диффузный хронический поверхностный пурулентный бурсит с эпителиальной гиперплазией, гипертрофией и значительной лимфоидной атрофией. Однако у этих цыплят не обнаруживали влияние на гуморальный ответ. В других исследованиях показано что C. baileyi вызывает супрессивный эффект на гуморальный иммуный ответ на патогенный вирус или вакцину от болезни Марека, болезни Гамборо, реовирус, живую вакцину от болезни Нью-Кастла, живую вакцину от инфекционного бронхита, на бруцеллез, и на живую вакцину от птичьего гриппа.
Кроме возможного иммуносупрессивного эффекта C. baileyi, при ассоцации инфекции вызванной C. baileyi и другимми патогенами повышается смертность и снижается прирост живой массы у цыплят. Факторами синергистами повышающими патогенность C. baileyi являются живые вирусвакцины от болезни Марека, инфекционной анемии птиц, болезени Гамборо, и реовируса. С другой стороны, в опытах не было выявлено синергизма с заражением цыплят токсоплазмами и криптоспоридиями (Toxoplasma gondii и C. baileyi).
Иммунитет.
Единичная кишечная и/или респираторная инфекция C. baileyi может вызвать достаточный имунный ответ у цыплят бройлеров, для полного удаления паразитов с инфицированных слизистых, и защитить птицу от реинфекции. Опыты на других животных показали что иммунитет может быть краткосрочным. Оральное или интратрахеальное введение ооцист цыплятам в возрасте 8-14 дней приводит к развитию паразитов на пораженных слизистых в течении 14-16 дней, потом наблюдалось быстрое отчищение от криптоспоридий. Высокий титр специфичных к C. baileyi антител в крови поддерживается после инфекции и приводит к развитию отложенной реакции гиперчувствительности к антигенам ооцист C. baileyi. Результаты серологических исследований показывают что приобретенный иммунитет защищает бройлеров на протяжении нескольких недель.
Лечение.
Экспериментальные условия in vitro.
Ооцисты Cryptosporidium parvum изолированные из помета бычков, отчищали, концентрировали, хранили в сбалансированном солевом растворе Ханкса при при 4С. В раствор добавляли препараты в разных концентрациях: монензин, толтразурил, их смесь в концентрациях (0, 0.1, 0.5, 1, 10, 20, 60 и 100μg/ml). Эффективность препаратов оценивалась подсчетом ооциист после 24 и 48 часов при инкубации при 37С.
Эксперимент показал что значительное снижение количества ооцист было связано с повышением концентрации и времени экспозиции препаратов.
Смесь двух препаратов была наиболее эффективна чем каждый из препаратов по отдельности. И монензин при той же концентрации был более эффективне чем толтразурил. Эти препараты действовали на ооцисты во всех концентрациях, при этом наиболее эффективное действие было при самой высокой концентрации в 100 μg/мл.
Исследования проведенные на бычках.
Бычков экспериментально лечили комбинацией азитромицина и толтразурила, и оценивали эффективность комплексного лечения и лечения только одним из препаратов.
55 телят голштинов больных криптоспоридиозом разделили на 4 группы. Одна группа получала азитромицин в дозировке 20 мг/кг 1 раз день, 6 дней; вторая группа получала толтразурил в дозировке 20 мг/кг 1 раз в день. 3 дня; третья группа получала комбинацию из двух препаратов; контрольная группа получала воду вместо препаратов. Было проведено рандомизированное, плацебо-контролируемое, двойное слепое клиническое исследование. Количество ооцист криптоспоридий и клиническое состояние животных исследовалось ежедневно. У телят получавших комбинацию толтразурила и азитромицина клиническое состояние было лучше и снижение количества ооцист было максимальным, таким образом исследователи пришли к выводу о том, что лечение телят от криптосподиоза комбинацией двух препаратов приводит к быстрому клиническому выздоровлению и прекращению выделения ооцист.
Нитазоксанид не применялся для птиц, но для бычков он эффективно снижал количество спороциcт в помете и способствовал улучшению состояния помета.
Литературные данные о лечении птиц от криптоспоридиоза.
Лечение птиц от криптоспоридиоза может быть очень сложной задачей. На данный момент времени не известно эффективных профилактических препаратов. Также не известно эффективных препаратов действующих на все виды криптоспоридий.
In vitro противокрипстоспоридиозная активность разной степени выраженности обнаружена для монензина, салимицина, альбориксина, лазалоцида, трифлуралана и никарбазина. Клинических исследования по применению этих препаратов для птиц нет. Но есть клинический опыт применения препаратов отраженный в публикациях разных авторов. Толтразурил, спирамицин, галофугинон применяли для лечения авдоток от C. parvum, азитромицин применялся для лечения совок (Otus spp) c C. baileyi, но при этом не было контрольных животных для оценки эффективности или безопасности.
При вспышке глазной формы криптоспоридиоза у птенцов сплюшек (Otus scops) вызванной C. baileyi применялся азитромицин в дозировке 40 мг/кг 1 раз в сутки.
Лечение криптоспоридиоза у солоколов и других хищников чаще всего не приносило успеха. Разные препараты применялись с разным успехом. В случае отита, трахеита, проблем в верхней части респираторной системы и центральной нервной системы, паромомицин применяемый в дозировке 100 мг/кг, перорально, два раза в день — был не эффективен. Азитромицин в дозировке 50 мг/кг перорально, два раза в день — был частично эффективен при лечении сплюшек в реабилитационном центре где 11 совок из 16 полностью выздоровели.
Нитазоксанид является единственным одобренным FDA препаратом для лечения криптоспоридиоза у детей и иммунокомпетентных взрослых.
Исходя из моего собственного опыта применения различных противопаразитарных препаратов для лечения птиц от криптоспоридиоза, я пришёл к выводу, что единственным эффективным препаратом, на данный момент, является нитазоксанид. Обновление от 14.10.24
У хищных птиц рабочим протоколом отраженным в публикациях было применение азитромицина 50 мг/кг, 1 раз в день, 1 месяц, вориконазоа пероорально 12.5 мг/кг 1 раз в день 1 месяц, и мелоксикама подкожно 1 мг/кг 1 неделю. Азитромицин был выбран так как есть публикации о его частично успешном применении для лечения хищников и о не эффективности паромомицина для лечения соколов.
Через 1 месяц терапии, обе балобана были переобследованы. Обе птицы набрали вес, помет у них все еще был положительный на криптоспоридий, гематологические и биохимические показатели были в пределах нормы. Эндоскопическое обследование остий, воздушных мешков и легких показало отсутствие значительных изменений.
Три гибрида кречета и балобана в Германии (Falco rusticolus × Falco cherrug) у которых был диагностирован респираторный криптоспоридиоз вызванный Cryptosporidium baileyi, получали паромомицин на протяжении нескольких недель. Никаких клинических улучшений у всех трех птиц замечено не было, птицы пали или были эвтаназированы.
Нейл Форбс и Альберто Родригез в 2007 г году публиковали информацию об успешном лечении двух соколов (кречет и гибрид кречета и сапсана) — от криптоспоридиоза паромомицином в дозировке 100 мг/кг дважды в день, в одном случае 7 дней, в другом 12 дней.
Наиболее эффективным препаратом снижающим выделение ооцист у птиц на 67-82% был паромомицин. Патентный период сокращался на 12-23%. Набор веса у цыплят получавших паромомицин был практически идентичен с неинфиуированными цыплятами. Токсичных эффектов препарата не отмечалось вне завивисимости от применяемых дозировок.
Паромомицин плохо всасывается из желудочно-кишечного тракта, поэтому малоэффективен при лечении от респираторной или других, не кишечных форм инфекции. На разных видах птиц паромомицин показал разную эффективность. Также при применении паромомицина отпечалась сильная абдоменальная боль, вероятно свазянная с раздражением слизистой стенки кишечника.
Азитромицин используется для лечения телят, людей и ткачиков от криптоспоридиоза — но также с разной эффективностью от околонулевой до значительного снижения выделения ооцист.
Отмеченно, что энрофлоксацин обладает свойством незначительно снижать эксрецию ооцист.
Зооантропонозное значение.
Криптоспоридиоз человека характеризуется довольно высокой заболеваемостью и при осложняющих обстоятельствах смертностью. Человек может заражаться через зараженную еду и воду содержащую ооцисты. Криптоспоридиоз человека является одной из частых причин диарейных болезней. Высокой степени заболеваемости способствует широкое распространение инфекционных ооцист криптоспоридий в природе, их устойчивость в окружающей среде, и небольшое количество ооцист необходимых для развиития заболевания, все это приводит к вспышкам заболевания при небольших количествах ооцист в питьевой и бытовой воде.
Эпидемиология инфекций комплексная и включает в себя передачу фекально-оральным путем, потребление зараженной воды и пищи, передачу от человека к человеку или от животных к человеку.
Несколько видов криптоспоридий является причиной криптоспоридиоза у человека. В 90% случаев, возбудителями является C. hominis и C. parvum, остальные виды реже вызывают инфекцию у человека, к ним относятся C. meleagridis, C. cuniculus, C. felis, и C. canis. Т.е. известными общими для птиц и человека возбудителями являются C. parvum и C. meleagridis.
Наибольший риск заражения C. parvum существует в контактных зоопарках, так как заражение происходит контактным путем с зараженными животными, людьми или при использовании загрязненной воды (питьевой или рекреационной), или еды.
Не смотря на то, что криптоспоридии колонизируют эпителиальные клетки гастроинтестиналього и респираторного трактов, человеческий криптоспоридиоз у здоровых людей обычно развивается как самоограничивающаяся инфекция с низким уровнем смертности. Проявление симптомов начинается через 5-6 дней после заражения и прекращается через 2-3 недели. Клинические признаки варьируют от субклинической инфекции до водянистой диареи, иногда профузной. Другие обычные признаки криптоспоридиоза это боли в животе, лихорадка, метеоризм, тошнота, субфебрильная температура.
Клинические признаки криптоспоридиоза у людей с нарушением функций Т-лимфоцитов (например с ВИЧ инфекцией) варьируют в зависимости от уровня иммуносупрессии — от ассимптоматического течения до ярко выраженных проявлений — рецидивирующая хроническая инфекция или даже холероподобная диарея, которая истощает человека и потенциально жизнеугрожающая.
Эпидемиологические исследования выявили наличие C. meleagridis у домашней птицы и в окружающей среде. Например в исследования в Алжире выявлено что C. meleagridis есть у 34% цыплят и у 44% индюшек. Однако в Китае зараженность домашней птицы C. meleagridis было намного меньше от 0.52% у бройлеров до 0.19% у кур несушек и 0,22% у перепелов, при этом Ли с сотоварищи в 2012 году было выяснили что C. meleagridis присуствует в 24,4% образцов сточных вод в четырех крупных городах в Китае.
Ооцисты C. parvum спорадически обнаруживают в образцах помета ассимтоматичеких птиц содержащихся как питомцы или в зоопарках. В большинсте случаев птицы являются просто переносчиками ооцист (NAKAMURA et al., 2009; QUAH et al., 2011). Однако, не смотря на то, что птицы редко инфицируются криптоспоридиями опасными для млекопитающих, водные птицы механически переносят ооцисты зоонозных видов криптоспоридий таких как C. parvum и C. hominis и могут быть участниками эпидеомиологической цепи в развитии криптоспоридиоза человека посредством загрязнения окружающей среды.
Наличие во внешней среде.
В Бразилии 84% сырых сточных вод и 8% сточных вод после обработки были положительными на криптоспоридий. C. muris, C. hominis, C. baileyi, C. parvum и C. suis обнаруживались в 100%, 19%, 9%, 9% и 4% сточных вод. C. muris были единственным видом криптоспоридий обнаруживаемых в сточных водах прошедших обработку. Несколько видов криптоспоридий в одной пробе обнаруживались в 19.04% сырых сточных вод.
В 1993 году крупнейшая вспышка криптоспоридиоза у людей из-за загрязнения питьевой воды была зафиксирована а в США в Милуоки. заболело более 400 тыс. человек. Эпидемиология заболевания сложная и включает в себя фекально-оральный путь и не прямая передача через загрязненную воду или еду или при прямой передаче от человека к человеку или от животного к человеку.
Ветеринарный врач, специалист по здоровью птиц, Валентин Козлитин.
Использованная литература:
1. Fowler, A. (2018), Current therapy in avian medicine and surgery. BL Speer (editor). Elsevier, 2016. 910 pages. Price A$175. ISBN 9781455746712.. Aust Vet J, 96: 175-175. https://doi.org/10.1111/avj.12604
2. State of the Art and Future Directions of Cryptosporidium spp. DOI: http://dx.doi.org/10.5772/intechopen.88387
3. First study of Cryptosporidium spp. occurrence in eared doves (Zenaida auriculata). Rev. Bras. Parasitol. Vet. vol.28 no.3 Jaboticabal July/Sept. 2019 Epub Aug 12, 2019 http://dx.doi.org/10.1590/s1984-29612019016
4. Cryptosporidium spp. in caged exotic psittacines from brazil: evaluation of diagnostic methods and molecular characterization ferrari, e. d. 1; Nakamura, a. a. 2; Nardi, a. r. m. 3; Santana, b. n. 1; Camargo, v. s. 1; Bresciani, k. d. s. ; Meireles, m. v
5. Rev. Bras. Parasitol. Vet. vol.28 no.2 Jaboticabal Apr./June 2019 Epub June 06, 2019 http://dx.doi.org/10.1590/s1984-29612019037
6. Diseases of poultry / editor-in-chief, David E. Swayne ; associate editors, Martine Boulianne [and 12 others]. Fourteenth edition. | Hoboken, NJ : Wiley-Blackwell, 2020. |
7. Cryptosporidium spp. in pet birds: Genetic diversity and potential public health significance. Qi M, Wang R, Ning C, Li X, Zhang L, Jian F, et al. Exp Parasitol. 2011;128:336–40. https://doi.org/10.1016/j.exppara.2011.04.003
8. Genetic polymorphism in Cryptosporidium species: An update. August 2009 Veterinary Parasitology 165(3-4):187-99
9. Cryptosporidium Pathogenicity and Virulence. Maha Bouzid, Paul R. Hunter, Rachel M. Chalmers, Kevin M. Tyler. Clin Microbiol Rev. 2013 Jan;26(1):115-34. doi: 10.1128/CMR.00076-12. https://cmr.asm.org/content/26/1/115
10. Cryptosporidium Avian Genotype III as a Possible Causative Agent of Chronic Vomiting in Peach-Faced Lovebirds (Agapornis roseicollis). Ikuko Makino, Niichiro Abe, Drury R. Reavill. Avian Diseases, 54(3):1102-1107 (2010). https://doi.org/10.1637/9227-123009-Case.1
11. A new avian Cryptosporidium genotype in a 1-month-old caged brown wood owl (Strix leptogrammica) with severe dehydration and diarrhea. Makino I, Inumaru M, Abe N, Sato Y. Parasitol Res. 2018 Sep;117(9):3003-3008. doi: 10.1007/s00436-018-5951-2. Epub 2018 Jun 6.
12. Gharagozlou MJ, Dezfoulian O, Rahbari S, Bokaie S, Jahanzad I, Razavi AN. Intestinal cryptosporidiosis in turkeys in Iran. J Vet Med A Physiol Pathol Clin Med. 2006; 53:282–285. doi: 10.1111/j.1439-0442.2006.00843.x.
13. Diagnosis of gastric cryptosporidiosis in birds using a duplex real-time PCR assay. Nakamura AA, Homem CG, da Silva AM, Meireles MV.Vet Parasitol. 2014; 205:7–13. doi:10.1016/j.vetpar. 2014.07.033.
14. Cryptosporidium infections in birds—a review. Nakamura AA, Meireles MV. Rev Bras Parasitol Vet. 2015; 24:253–267. doi:10.1590/S1984-29612015063.
15. Proventriculitis associated with Cryptosporidium baileyi in a snowy owl (Bubo scandiacus) and its epidemiological investigation. Nakagun S, Horiuchi N, Sugimoto M, Tomikawa S, Watanabe K, Kobayash i Y (2017). J Parasitol 103:451–457
16. Cryptosporidium baileyi infection associated with an outbreak of ocular and respiratory disease in otus owls (Otus scops) in a rehabilitation Centre. Avian. Molina-Lopez RA, Ramis A, Martin-Vazquez S, Gomez-Couso H, Ares- Mazas E, Caccio SM, Leiva M, Darwich L (2010). Avian Pathol 39:171–176
17. Otitis media associated with Cryptosporidium baileyi in a Saker falcon (Falco cherrug). Bougiouklis PA, Weissenböck H, Wells A, Miller WA, Palmieri C, Shivaprasad HL. Comp Pathol 2013; 148(4): 419-423. http://dx.doi.org/10.1016/j.jcpa.2012.09.005.
18. First detection of Cryptosporidium parvum in falcons (Falconiformes): Diagnosis, molecular sequencing, therapeutic trial and epidemiological assessment of a possible emerging disease in captive falcons. Panagiotis Azmanis, Antonio Di SommaAntonio Di Somma, Lucia Pappalardo, Berit BangouraB, att all. February 2018 Veterinary Parasitology 252, https://doi.org/10.1016/j.vetpar.2018.02.012
19. Conjunctivitis, rhinitis, and sinusitis in cliff swallows (Petrochelidon pyrrhonota) found in association with Mycoplasma sturni infection and cryptosporidiosis. Ley DH, Moresco A, Frasca S Jr. Avian Pathol 2012; 41(4): 395-401. http://dx.doi.org/10.1080/03079457.2012.697624. PMid:22834555.
20. Cryptosporidium baileyi — infection in Red-breasted Merganser (Mergus serrator) ducklings from a zoological garden. Schulze C, Kämmerling J, Kutzer P, Engelhardt A, Richter B. Berl Munch Tierarztl Wochenschr 2012; 125(9- 10): 428-431. PMid:23045806.
21. First detection of Cryptosporidium parvum in falcons (Falconiformes): Diagnosis, molecular sequencing, therapeutic trial and epidemiological assessment of a possible emerging disease in captive falcons. Azmanis P, di Somma A, Pappalardo L, Silvanose CD, Bangoura B. Vet Parasitol. 2018 Mar 15;252:167-172. doi:10.1016/j.vetpar.2018.02.012
22. Upper Respiratory Tract Infection Caused by Cryptosporidium baileyi in Three Mixed-Bred Falcons (Falco rusticolus × Falco cherrug). Y. R. A. van Zeeland, N. J. Schoemaker, M. J. L. Kik, and J. W. B. van der Giessen. Avian Diseases 52(2), 357-363, (1 June 2008). https://doi.org/10.1637/8121-100207-Case.1
23. Parasitological and molecular detection of Cryptosporidium parvum in rheas (Rhea americana). Krindges, M.M., Almeida, A.B., Araujo, D.N., Stefan, L.M., da Silva, A.S., 2013. Acta Sci. Vet. 241, 01–04.
24. Cryptosporidium proventriculi sp. n. (Apicomplexa: Cryptosporidiidae) in Psittaciformes birds. Holubová N, Zikmundová V, Limpouchová Z, Sak B, Konečný R, Hlásková L, Rajský D, Kopacz Z, McEvoy J, Kváč M.. Eur J Protistol. 2019 Jun;69:70-87. doi: 10.1016/j.ejop.2019.03.001.
25. Cryptosporidium sp. infection in the proventriculus of an Australian diamond firetail finch (Staganoplura bella: Passeriformes, Estrildidae). Blagburn, B.L., Lindsay, D.S., Hoerr, F.J., Atlas, A.L., Toivio- Kinnucan, M., 1990. Avian Dis. 34, 1027–1030, http://dx.doi.org/10.2307/1591401.
26. Detection and molecular characterization of Cryptosporidium spp. in captive canaries (Serinus canaria) using different diagnostic methods. Camargo, V.D., Santana, B.N., Ferrari, E.D., Nakamura, A.A., Nagata, W.B., Nardi, A.R.M., Meireles, M.V., 2018. Rev. Bras. Parasitol. 27, 61–66, http://dx.doi.org/10.1590/S1984-296120180010.
27. First description of Cryptosporidium parvum in carrier pigeons (Columba livia). Oliveira, B.C.M., Ferrari, E.D., Panegossi, M.F.D., Nakamura, A.A., Corbucci, F.S., Nagata, W.B., dos Santos, B.M., Gomes, J.F., Meireles, M.V., Widmer, G., Bresciani, K.D.S., 2017. Vet. Parasitol. 243, 148–150, http://dx.doi.org/10.1016/j.vetpar.2017.06.023.
28. Natural infection of Cryptosporidium muris in ostriches (Struthio camelus). Qi, M., Huang, L., Wang, R., Xiao, L., Xu, L., Li, J., Zhang, L., 2014. Vet. Parasitol. 205, 518–522, http://dx.doi.org/10.1016/j.vetpar.2014.06.035.
29. Use of paromomycin in the treatment of a Cryptosporidium infection in two falcons. Rodriguez-Barbon A, Forbes N (2007). Proceedings of the 9th Conference of the Asso- ciation of European Avian Veterinarians, E Bergman, Ed., Zurich, Switzerland, pp. 191-198.
30. Cryptosporidiosis and Toxoplasmosis in Native Quails of Egypt. Raafat M. Shaapan, Fathia A.M. Khalil and Nadia, M.T. Abu El Ezz, 2011. Journal of Veterinary Sciences, 4: 30-36.
31. Cryptosporidium avium n. sp. (Apicomplexa: Cryptosporidiidae) in birds. Nikola HolubováBohumil SakMichaela HorčičkováLenka HláskováDana KvětoňováSarah MenchacaJohn McEvoyMartin Kváč. Parasitol Res (2016) 115: 2243. https://doi.org/10.1007/s00436-016-4967-8
32. Anticryptosporidial prophylactic efficacy of enrofloxacin and paramomycin in chickens. Sre ́ter, T., Sze ́ll, Z.; Varga, I. (2002) Journal of Parasitology, 88, 209-211.
33. Cryptosporidiosis in four cockatoos with psittacine beak and feather disease. Latimer KS, Steffens WL 3rd, Rakich PM, Ritchie BW, Niagro FD, Kircher IM, Lukert PD. J Am Vet Med Assoc. 1992;200(5):707– 710.
34. «Renal and cloacal cryptosporidiosis (cryptosporidium avian genotype v) in a major mitchell’s cockatoo (lophochroa leadbeateri),» Jeffrey B. Curtiss, Angelique M. Leone, James F. X. Wellehan Jr., Jessica A. Emerson, Elizabeth W. Howerth, and Lisa L. Farina. Journal of Zoo and Wildlife Medicine 46(4), 934-937, (1 December 2015). https://doi.org/10.1638/2015-0025.1
35. Conjunctivitis, rhinitis, and sinusitis in cliff swallows (Petrochelidon pyrrhonota) found in association with Mycoplasma sturni infection and cryptosporidiosis. David H. Ley , Anneke Moresco; Salvatore Frasca Jr (2012). Avian Pathology, 41:4, 395-401, DOI: 10.1080/03079457.2012.697624
36. Natural infection with Cryptosporidium galli in canaries (Serinus canaria), in a cockatiel (Nymphicus hollandicus) and in lesser seed-finches (Oryzoborus angolensis) and in lesser seed-finches (Oryzoborus angolensis) from Brazil. Antunes RG, Simões DC, Nakamura A, Meireles MV (2008). Avian Dis 52:702–705
37. Physical, epidemiological, and molecular evaluation of infection by Cryptosporidium galli in Passeriformes. Deuvânia C. da Silva; Camila G. Homem Alex A. Nakamura; Weslen Fabrício P. Teixeira; Sílvia Helena V. Perri; Marcelo V. Meireles. Parasitol Res (2010) 107:271–277. DOI 10.1007/s00436-010-1858-2
38. Cryptosporidium in birds, fish and amphibians. Una Ryan. (2010) Experimental Parasitology 124 (113–120).
39. Cryptosporidium Taxonomy: Recent Advances and Implications for Public Health. Xiao L, Fayer R, Ryan U, Upton SJ. Clin Microbiol Rev. 2004 Jan;17(1):72-97.
40. Effects of two anticoccidial drugs, Monensin, Toltrazuril and the mixture of them on Cryptosporidium parvum in vitro. Fathi M, Sadraei J, Ghaffarifar F. Jundishapur J Microbiol. 2011; 4(2): 71-4.
41. The efficacy of a combination of azithromycin and toltrazuril for the treatment of calves naturally infected with cryptosporidiosis: a randomised, double-blind, placebo-controlled comparative clinical trial. Yagci B.B., Ocal N., Yasa Duru S., Akyol M. (2017). Veterinarni Medicina, 62: 308-314. https://doi.org/10.17221/125/2015-VETMED
42. A chicken embryo model for the maintenance and amplification of Cryptosporidium parvum and Cryptosporidium baileyi oocysts. June 2020 European Journal of Protistology DOI: 10.1016/j.ejop.2020.125718
43. Vladimir Vrba, Michal Pakandl, Coccidia of turkey: from isolation, characterisation and comparison to molecular phylogeny and molecular diagnostics. International Journal for Parasitology, Volume 44, Issue 13, 2014, Pages 985-1000, ISSN 0020-7519, https://doi.org/10.1016/j.ijpara.2014.06.004. (https://www.sciencedirect.com/science/article/pii/S0020751914001489)
44. Ocorrência de cryptosporidium spp. em psitacídeos exóticos mantidos em cativeiro nas regiões sul e sudeste do brasil: avaliação de métodos de diagnóstico e classificação molecular. Elís Domingos Ferrari