Содержание:
Характеристика реовирусов птиц
Реовирусы птиц: род Ортореовирусы (Orthoreovirus) — безоболочечные РНК-содержаще вирусы, входящие в семейство Reoviridae. Вирион имеет размер 70-80 нм, икосаэдральную форму. Геном двойной РНК спирали содержит 10-12 сегментов. Геном кодирует восемь структурных протеинов (λA, λB, λC, μA, μB, σA, σB, σC) и четыре неструктурных протеина (μNS, P10, P17, σNS). Место главной репликации реовирусов птиц — эпителиальные клетки тонкого кишечника и бурсы Фабрициуса, откуда в течение 24-48 часов после заражения вирус распространяется во все органы и ткани. Реовирусы вызывают большое количество болезней у птиц разных видов. У цыплят и индюшат реовирусная инфекция протекает с развитием артритов/теносиновитов. У куриных отмечается и развитие миокардитов, панкреатитов, гептитов и энтеритов. У попугаев и гусей реовирусная инфекция вызывает некротизирующий гепатит и спленит.
Реовирусы выделялись от здоровых и от больных птиц, часто инфекция протекает с большим количеством других вторичных заболеваний, что требует тщательного анализа клинического значения каждой обнаруженной инфекции.
Особенности течения инфекции у врановых
Реовирусы (Avian reovirus ARV) являются частыми возбудителями болезней врановых птиц, протекающих с большой смертностью. Инфекция зарегистрирована в Северной Америке у американских воронов Corvus brachyrhynchos (США, Канада); в Европе — у серой вороны Corvus corona cornix (Финляндия), черной вороны Corvus corone (Бельгия), обыкновенной галки Corvus monedula (Польша). Справедливости ради, надо сказать, что в Европе и в странах СНГ не проводится активный мониторинг болезней диких птиц, как это делается в Северной Америке, поэтому фактических данных о распространении эпизоотий реовирусов среди врановых птиц в Европе и, в частности, в России — очень мало.
Врановые птицы очень чувствительны к вирусу лихорадки Западного Нила (West Nile Virus WNV), поэтому в Европе и в Северной Америке дикие врановые служат «естественными индикаторами» развития эпидемий, вызванных флавивирусами (Flaviviridae); в ходе исследований эпизоотий, вызванных вирусом лихорадки Западного Нила, исследователями открыто, что схожую неврологическую симптоматику (неспособность летать, судороги, кривошея, отсутствие реакции на приближение человека и домашних животных) у врановых птиц вызывает и реовирус, к которому врановые птицы оказались очень чувствительны. Таким образом, исследование одного вируса открыло неизвестное ранее заболевание диких врановых птиц.
Реовирус у обыкновенной сороки
Ниже представлено детальное описание обследования погибшей обыкновенной сороки (Pica pica) в Англии, где была выявлена реовирусная инфекция.
Состояние больной птицы
Сорока (взрослая самка) была обнаружена умирающей без специфических признаков болезней птиц. Птица погибла вскоре после того, как ее подобрали реабилитаторы. Паткартина при вскрытии была следующая: истощение — значительно снижена масса грудного мускула, отсутсвие подкожного жира; кожа плотно соединена с подкожной клетчаткой — признак обезвоживания. Хвостовое оперение и маховые перья в плохом состоянии, со множеством переломов остей и с большим количеством стресс-линий, указывающих на хроническое течение болезни.
Патологоанатомические признаки (паткартина)
Печень: значительно увеличена (гепатомегалия), с закругленными краями, паренхима оранжевого цвета с миллиарными бесцветными очагами. Селезенка увеличена (спленомегалия), со множественными очагами кровоизлияний. Бурса Фабрициуса не обнаружена. Легкие билатерально кровенаполнены. Воздушные мешки и перикард светло желтого цвета, слегка утолщены и не прозрачны. В ротовой полости обширный очаг светло кремового цвета, рыхлой консистенции, прикрепленный к слизистой неба и распространяющийся на дно ротовой полости вокруг языка. Железистый и мускульный желудок пустые. В тонким кишечнике выявлено умеренное количество жидкого химуса, окрашенного кровью, сосуды брыжейки сильно кровенаполнены. Толстый кишечник содержит умеренное количество пастообразного темно-коричневого материала. Надпочечники увеличены, хорошо заметны. Сосуды головного мозга кровенаполнены.
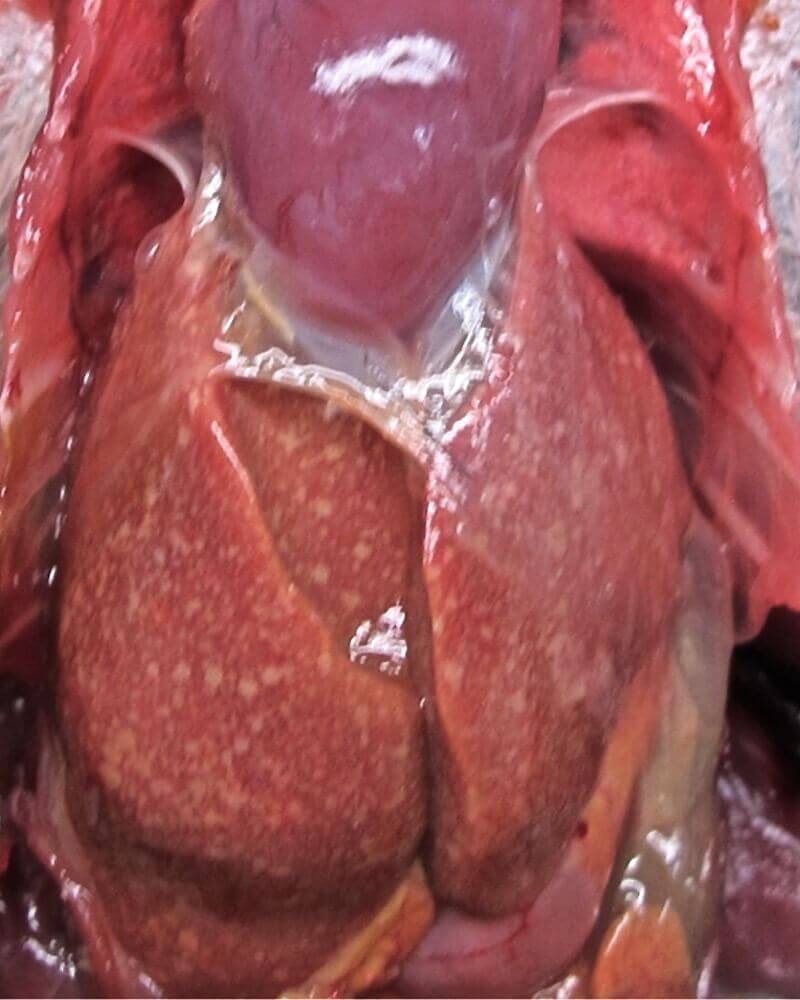
Печень сороки погибшей от реовирусной инфекции на вскрытии. Патологоанатомическая картина гепатомегалии, изменние цвета печени, милиарные очаги некроза. Сердце: гидроперикардит. Источник: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) in Great Britain. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
Бактериологический анализ
При бактериологическом анализе печени, содержимого кишечника и наложения из ротовой полости — из тканей печени и содержимого кишечника выделена чистая культура Escherichia coli. Посевы в анаэробной среде не выявили признаков клостридий (Clostridium spp). Окраска мазков отпечатков печени по Цилю-Нильсену не выявила кислотоустойчивых микроорганизмов.
Aspergillus fumigatus был выделен из массы наложений из ротовой полости при посеве на декстрозный Сабуро агар с хлорамфениколом. Нативные мазки, сделанные из наложений в ротовой полости и разведенные физиологическим раствором, не выявили никаких протозойных или метазойных паразитов. Посевы небольшого кусочка из наложений в ротовой полости на среды для культивации из трихомонад были негативны на T. gallinae.
Микроскопия содержимого тонкого кишечника не выявила каких-либо паразитов.
Гистологический анализ
Кусочки внутренних органов были помещены в 10% раствор нейтрально забуференного раствора формалина, после чего были сделаны гистологические препараты по стандартной схеме. К стандартной окраске гистологических препаратов Гематоксилин-Эозином было дополнительно проведено окрашивание препаратов тканей по Гимзе, Грамму, Perls’ Prussian Blue, по Шиффу (Periodic Acid-Schiff) и по Цилю-Нильсену.
Гистологический анализ выявил обширные зоны сливного острого некротического гепатита, ассоциированного с отложением гемосидерина (обнаруженного окраской Perls’ Prussian Blue). Зоны некроза печени были достаточно массивны (что могло привести к гибели птицы от печеночной недостаточности). Также был обнаружен очаговый холангит средней степени тяжести, вызванный закупоркой желчных протоков трематодами. Селезенка: сливной, острый очаговый некроз пульпы, отек, очаги геморрагий в паренхиме, диффузная лимфоидная атрофия. Надпочечники: диффузная кортикальная гиперплазия. В тканях головного мозга поражений не обнаружено.

Гистологический препарат тканей печени и селезенки сороки, погибшей от реовирусной инфекции. А. Очаг сливного острого некроза гепатоцитов. Окраска гематоксилин-эозином. Увеличение 200. В. Фибринозный некроз селезенки. Окраска гематоксилин-эозином. Увеличение 200.
С-D. Демонстрация РНК реовируса птиц при in-situ гибридизации в клетках (стрелки) из очагов поражения в печени (С) и селезенке (D).
Источник: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) in Great Britain. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
Вирусологические анализы
Ткани мозга и почек сороки были обследованы методом ПЦР с использованием праймеров для вируса лихорадки Западного Нила (West Nile virus) и праймеров общих для флавивирусов. Результаты были отрицательные. Ткани почек и селезенки были обследованы методом ПЦР на наличие генетических материалов общих для герпесвирусов — результат был отрицательный.
Гомогенат тканей печени и содержимого тонкого кишечника был обследован с помощью негативной контрастной электронной микроскопии, что выявило наличие вирусных частиц размером 77-78 нм; форма вирионов в обоих образцах соответствовала реовирусам.

Трансмиссивная электронная микрография реовируса, выделенного при культивровании материала из тканей печени сороки. Полоска 100 нм.
Источник: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) in Great Britain. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
Молекулярная диагностика
После этого был проведен ПЦР анализ тканей печени и селезенки с праймерами L2 сегмента генома общего для реовирусов. Реакция на ген L2 реовирусов (рнк-зависимая РНК полимераза — примерно 274 оснований) была положительная.
Также, было проведено выделение вируса из тканей печени, почек, содержимого тонкого кишечника на культуре клеток. В обоих случаях (материал из почек/печени и содержимое тонкого кишечника) — был выявлен цитопатический эффект. Электронная микроскопия культур тканей выявила вирусные частицы аналогичные тем, что были выявлены из нативных тканей печени и содержимого тонкого кишечника.
С помощью in-situ гибридизации было выполнено иммуногистохимическое исследование тканей печение и селезенки, выявившее преимущественное скопление вирусных частиц в областях некроза и прилегающей паренхимы (см. фото гистологического препарата).
Филогенетическое дерево вируса, построенное на основании анализа 285 аминокислот протеина С, показало, что вирус, выделенный от сороки, был близок к реовирусу кур, выделяемому в Индии, США и в Китае, и довольно далек от реовирусов кур, выделяемых в континентальной Европе.
Вторичные инфекции и заключение
Печень и селезенка у этой сороки были поражены также, как это описано для попугаев, больных реовирусной инфекцией. Некротизирующий спленит часто описывают у ворон с реовирусом. У врановых птиц часто описывают неврологические симптомы; эта сорока не могла летать когда ее нашли, однако никаких признаков поражения центральной нервной системы не было обнаружено, кроме кровенаполненных сосудов головного мозга. Обнаруженный аспергиллезный некротизирующий стоматит, вызванный Aspergillus fumigatus , являлся вторичной инфекцией, развивающейся у ослабленной птицы. Лимфоидное истощение и, как следствие, иммунносупрессия и развитие вторичных бактериальных и грибковых болезней птиц — также часто описываемые признаки реовирусной инфекции. Так как гистологическое исследование не выявило диссеминированных бактериальных колоний или явно выраженного воспалительного процесса — значит выделение кишечной палочки из разных органов и содержимого кишечника скорее всего свидетельствует о посмертной бактериальной инвазии, нежели о диссеминированной системной инфекции.
Близость генома реовируса выделенного у сороки к реовирусам кур в Северной Америке, Индии, Израиля, Китая, но не к геному реовирусов, выделяемых от кур Северо-Западной Европы, — остается не понятной. Это же говорит и о том, что дикие врановые могут заражаться от промышленно разводимых птиц на птицефабриках.
Гибель американских воронов (Corvus brachyrhynchos) от реовирусной инфекции в Канаде
Инфекция протекала стремительно, большинство погибших птиц были хорошо упитаны без каких-либо признаков истощения. Наиболее заметным патологоанатомическим признаком было геморрагическое воспаление тонкого кишечника. У некоторых погибших воронов был обнаружен сопутствующий спленит с очагами некроза паренхимы.
Птицы были обследованы на наличие вируса лихорадки Западного Нила, который является частой причиной гибели врановых птиц в Северной Америке, и на наличие птичьего гриппа — все анализы были отрицательными. Бактериологические анализы не выявили никаких возбудителей инфекций у погибших воронов. Признаков отравления на вскрытии выявлено не было.
Статья о бактериальных инфекциях воробьиных птиц, в том числе о болезнях врановых.
Анализы тканей печени, селезенки, почек и кишечника были положительными на реовирусную инфекцию. Какие именно анализы были сделаны — в заметке не уточняется.
С 2000 года, по данным национального центра здоровья дикой природы (NWHC USGS Madison Wi.), гибель американских воронов от реовируса отмечается в разных районах США.

Геморрагический энтерит у американского ворона (Corvus brachyrhynchos) погибшего от отстрой реовирусной инфекции. Источник: Canadian Cooperative Wildlife Health Centre
Реовирус у серой вороны
В Финляндии реовирус был выделен от серой вороны (Corvus corone cornix) с нарушением координации полета, судорогами, не нормальным положением тела и параличом.
Вирус был назван Tvärminne avian virus (TVAV); исследователи полагают, что это новый вид реовирусов. Новый вирус не агглютинировал эритроциты цыплят, гусей или человека.
Реовирус у галок
В Польше реовирус был обнаружен у галок (Corvus monedula); патологоанатомические и клинические признаки не описаны.
Дифференциальный диагноз
Отличие в развитии болезней врановых птиц, вызванных лихорадкой Западного Нила и реовирусами, заключается в том, что при лихорадке Западного Нила поражается центральная нервная система птиц, а реовирусы поражают тонкий кишечник, вызывая геморрагический и некротизирующий энтерит, селезенку и печень и только потом уже распространяются в центральную нервную систему. Также важным отличием этих инфекций является способ передачи: западнонильская лихорадка переносится кровососущими насекомыми, а реовирусы распространяются орально-фекальным путем. Таким образом, реовирусные инфекции вспыхивают в зимнее время в местах массовых ночевок врановых птиц.
Лечение
Специфического лечения реовирусной инфеции у ворон, сорок, соек, галок и грачей не разработано. При своевременном обращении к ветеринарному врачу и начале поддерживающего лечения возможно снизить уровень смертности птиц. Если не допустить развития вторичных бактериальных и грибковых болезней, то заболевшая птица может выжить.
Профилактика
Реабилитаторам надо знать, что карантин должен соблюдаться очень строго, так как принеся в приют, где уже содержатся врановые птицы, больную ворону, сороку, грача, галку можно заразить всех птиц. Все вновь поступающие в приют или реабилитационный центр птицы должны проходить через карантинирование.
Реовирусы птиц очень устойчивы к обычным дезинфектантам и к ультрафиолету. Именно по этому необорудованные приюты для врановых птиц со сборно-щитовыми-дощатыми вольерами могут оставаться постоянным очагом инфекции.
После вспышки реовирусной инфекции в приюте рекомендуется полная замена всех присад и инвентаря, который невозможно полностью обработать растворами.
Ветеринарный врач, птичий доктор Козлитин В.Е.
Использованная литература:
- Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) in Great Britain. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
- Campbell D, Barker DIK, Wobeser G. Reovirus in crows – an emerging disease? Wildlife Health Centre Newsletter. Can Cooperative Wildlife Centre. 2004;10(1):8.
- Huhtamo E, Uzcátegui NY, Manni T, Munsterhjelm R, Brummer-Korvenkontio M, Vaheri A, et al. Novel orthoreovirus from diseased crow, Finland . Emerg Infect Dis. 2007 Dec.
- Meteyer C, Docherty D, Ip H, Ramsey N, Saito E, Oaks L: Reovirus-associated necrotizing enteritis in American crows.
- Detection of avian reoviruses in wild birds in Poland Natalia Styś-Fijoł, Wojciech Kozdruń, Hanna Czekaj, Department of Poultry Diseases, National Veterinary Research Institute, 24-100 Pulawy, Poland natalia.stys@piwet.pulawy.pl J Vet Res 61, 239-245, 2017 DOI: 10.1515/jvetres-2017-0033
